 氧化還原反應是一類重要的化學反應,廣泛存在于生產和生活中。對我們的生產和生活中可能同時具有正負兩方面的影響,如果我們能夠掌握化學變化的規律,就有可能做到趨利避害,使之更好地為社會的發展服務。下面我們逐一分析:
氧化還原反應是一類重要的化學反應,廣泛存在于生產和生活中。對我們的生產和生活中可能同時具有正負兩方面的影響,如果我們能夠掌握化學變化的規律,就有可能做到趨利避害,使之更好地為社會的發展服務。下面我們逐一分析:
(1)黑火藥是我國古代的四大發明之一。黑火藥著火時,發生如下氧化還原反應:2KNO3+S+3C═K2S+N2↑+3CO2↑。在此反應中,被還原的元素為 N、SN、S(填元素符號),氧化產物是 CO2CO2(填化學式),4.8g S參加反應時,產生氣體的體積為 13.4413.44L(標況下)。
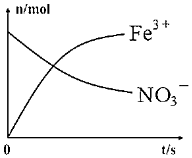
(2)硝酸是一種具有強氧化性的無機酸,是六大無機強酸之一,也是一種重要的化工原料,常用于制造氮肥、硝酸鹽、硝化甘油等。某硝酸溶液的密度為1.42g?cm-3,質量分數為63%,請計算其物質的量濃度為 14.214.2mol/L。另有一容器中發生某化學反應,反應過程中存在Fe2+、H+、NO-3、Fe3+、NH+4和H2O六種粒子,在反應過程中測得Fe3+、NO-3的物質的量隨時間變化的曲線如圖所示,請你寫出此離子反應方程式:8Fe2++NO-3+10H+=8Fe3++NH+4+3H2O8Fe2++NO-3+10H+=8Fe3++NH+4+3H2O。
(3)汽車劇烈碰撞時,安全氣囊中發生反應:10NaN3+2KNO3═K2O+5Na2O+16N2↑。若反應得到的氧化產物比還原產物多0.7 mol,則此過程中轉移電子的物質的量為 0.50.5mol。
(4)Cu2S與一定濃度的HNO3反應,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,當NO2和NO的個數之比為2:1時,實際參加反應的Cu2S與表現氧化性的HNO3的個數之比為 1:61:6。
(5)一定量的某磁黃鐵礦(主要成分FexS,S為-2價)與100mL鹽酸恰好完全反應(礦石中其他成分不與鹽酸反應),生成3.2g硫單質、0.4mol FeCl2和一定量H2S氣體,且溶液中無Fe3+,該磁黃鐵礦中FexS的x= 0.80.8。
NO
-
3
NH
+
4
NO
-
3
NO
-
3
NH
+
4
NO
-
3
NH
+
4
【考點】氧化還原反應的計算.
【答案】N、S;CO2;13.44;14.2;8Fe2+++10H+=8Fe3+++3H2O;0.5;1:6;0.8
NO
-
3
NH
+
4
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:33引用:1難度:0.5
相似題
-
1.將一定量鋅與100mL 18mol/L濃硫酸充分反應后,若鋅完全溶解同時產生氣體0.8mol,將反應后的溶液稀釋得400mL,測得溶液o(H+)=2mol/L,則下列敘述中錯誤的是( )
A.氣體中SO2和H2物質的量比為6:1 B.反應中共消耗鋅52.0g C.所得氣體應該為SO2和H2混合物 D.反應共轉移電子1.6mol 發布:2024/12/30 4:30:1組卷:80引用:5難度:0.4 -
2.向100mL 18mol/L的硫酸溶液中加入足量的銅片并加熱,充分反應后,被還原的硫酸物質的量( )
A.小于0.9 mol B.等于0.9 mol C.在0.9 mol到1.8 mol之間 D.大于1.8 mol 發布:2024/12/30 14:0:1組卷:33引用:2難度:0.9 -
3.已知硫代硫酸鈉可作為脫氯劑,25.0mL0.100mol?L-1的Na2S2O3溶液恰好把224mL(標準狀況下)Cl2轉化為Cl-,則S2
將轉化為( )O2-3A.S2- B.S C. SO2-3D. SO2-4發布:2024/12/30 4:30:1組卷:134引用:5難度:0.5


