2021-2022學年山東省聊城一中高一(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題:本題共10小題,每小題2分,共20分。每小題只有一個選項符合題目要求。
-
1.2021年10月16日,搭載神舟十三號載人飛船的長征二號F遙十三運載火箭,在酒泉衛星發射中心成功發射,順利將翟志剛、王亞平、葉光富3名航天員送入太空,“可上九天攬月”成為現實。下列涉及火箭發射及其系列材料中,主要成分均為非金屬單質的是( )
A.可作為運載火箭發動機推進劑的液氧和液氫 B.制作神舟十三號飛船蒙皮、側壁、物品柜板的鋁材 C.返回艙減速傘材料是含碳氫等元素的錦綸纖維 D.返回器表面所貼的“暖寶寶”主要成分為鐵粉、碳粉 組卷:12引用:2難度:0.7 -
2.分類是化學研究中常用的方法。下列分類方法中正確的是( )
A.硫酸、鹽酸、CuSO4?5H2O都屬于化合物 B.金屬氧化物一定是堿性氧化物 C.單質都是由同種元素組成的,只含一種元素的物質一定是純凈物 D.純堿是Na2CO3,燒堿是NaOH,二者都屬于電解質 組卷:8引用:1難度:0.6 -
3.朱自清先生在《荷塘月色》中寫道:“薄薄的青霧浮起在荷塘里……月光是隔了樹照過來的,高處叢生的灌木,落下參差的斑駁的黑影…”能形成上述月光穿過薄霧的美景的本質原因是( )
A.薄霧是均一、透明的 B.薄霧能發生丁達爾效應 C.薄霧中分散質微粒直徑約為1~100nm D.薄霧中分散質微粒進行布朗運動 組卷:8引用:1難度:0.7 -
4.下列離子方程式中,正確的是( )
A.NaHSO4溶液中逐滴滴入Ba(OH)2至溶液呈中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O B.工業漂白液的制備:Cl2+2OH-═Cl-+ClO-+H2O C.將稀硫酸滴在銅片上:Cu+2H+═Cu2++H2↑ D.氯氣與水反應:Cl2+H2O═2H++Cl-+ClO- 組卷:6引用:1難度:0.6 -
5.下列離子能大量共存的是( )
A.含有大量H+的溶液中:Na+、Fe2+、NO3-、NH4+ B.無色透明的溶液中:K+、Fe3+、SO42-、NO3- C.常溫下,pH>7的溶液中:Na+、K+、SO42-、CO32- D.紫色石蕊試液呈藍色的溶液中:Cu2+、K+、SO32-、NO3- 組卷:13引用:2難度:0.7 -
6.實現下列物質之間的轉化,需要加入還原劑才能實現的是( )
A.KClO3→O2 B.CuO→Cu C.SO3→H2SO4 D.FeCl2→FeCl3 組卷:7引用:1難度:0.7
三、非選擇題:本題共4小題,共60分。
-
18.氯氣是一種重要的化工原料,能與有機物和無機物發生反應生成多種氯化物。現用如圖裝置制取氯氣并進行一系列的實驗探究。請分析下列問題:
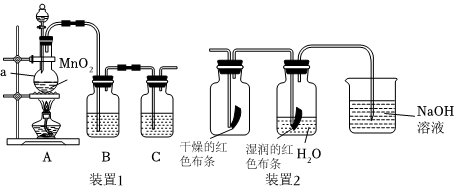
(1)裝置1用來制備純凈、干燥的氯氣。發生反應時,裝置A中被氧化的HCl與消耗的HCl的質量比為。儀器a的名稱為,裝置B中盛放的液體為,裝置C的作用是。
(2)將裝置1與裝置2連接,探究氯氣是否具有漂白性。將氯氣依次通過盛有干燥紅色布條的集氣瓶和盛有濕潤紅色布條的集氣瓶,可觀察到的現象是。為防止氯氣逸出污染空氣,實驗室中可用氫氧化鈉溶液吸收多余的氯氣。運用上述原理,也可制得84消毒液(主要成分為NaClO)。家庭中,我們常用84消毒液、潔廁靈(主要成分鹽酸)等消毒殺菌、清潔衛生,但需特別注意:以上二者不可同時使用,否則會產生有毒的氯氣,請你寫出這一反應的離子方程式。組卷:4引用:1難度:0.8 -
 19.氧化還原反應是一類重要的化學反應,廣泛存在于生產和生活中。對我們的生產和生活中可能同時具有正負兩方面的影響,如果我們能夠掌握化學變化的規律,就有可能做到趨利避害,使之更好地為社會的發展服務。下面我們逐一分析:
19.氧化還原反應是一類重要的化學反應,廣泛存在于生產和生活中。對我們的生產和生活中可能同時具有正負兩方面的影響,如果我們能夠掌握化學變化的規律,就有可能做到趨利避害,使之更好地為社會的發展服務。下面我們逐一分析:
(1)黑火藥是我國古代的四大發明之一。黑火藥著火時,發生如下氧化還原反應:2KNO3+S+3C═K2S+N2↑+3CO2↑。在此反應中,被還原的元素為(填元素符號),氧化產物是(填化學式),4.8g S參加反應時,產生氣體的體積為L(標況下)。
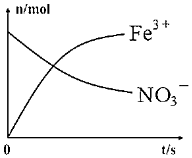
(2)硝酸是一種具有強氧化性的無機酸,是六大無機強酸之一,也是一種重要的化工原料,常用于制造氮肥、硝酸鹽、硝化甘油等。某硝酸溶液的密度為1.42g?cm-3,質量分數為63%,請計算其物質的量濃度為mol/L。另有一容器中發生某化學反應,反應過程中存在Fe2+、H+、、Fe3+、NO-3和H2O六種粒子,在反應過程中測得Fe3+、NH+4的物質的量隨時間變化的曲線如圖所示,請你寫出此離子反應方程式:NO-3。
(3)汽車劇烈碰撞時,安全氣囊中發生反應:10NaN3+2KNO3═K2O+5Na2O+16N2↑。若反應得到的氧化產物比還原產物多0.7 mol,則此過程中轉移電子的物質的量為mol。
(4)Cu2S與一定濃度的HNO3反應,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,當NO2和NO的個數之比為2:1時,實際參加反應的Cu2S與表現氧化性的HNO3的個數之比為。
(5)一定量的某磁黃鐵礦(主要成分FexS,S為-2價)與100mL鹽酸恰好完全反應(礦石中其他成分不與鹽酸反應),生成3.2g硫單質、0.4mol FeCl2和一定量H2S氣體,且溶液中無Fe3+,該磁黃鐵礦中FexS的x=。組卷:33引用:1難度:0.5


