化學工業中Mn可用作氧化劑、助燃劑、活性電極材料、催化劑、油漆和油墨的干燥劑等,碳酸錳礦可作為制備MnO2原料
(1)已知25℃,101kPa時有如下的三個熱化學方程式
①MnCO3(s)?MnO(s)+CO2(g)ΔH1=+116 6kJ/mol
②2MnO(s)+O2(g)?2MnO2(s)ΔH2=-272.0kJ/mol
③2MnCO3(s)+O2(g)?2MnO2(s)+2CO2(g)ΔH3
則ΔH3=-38.8kJ/mol-38.8kJ/mol;反應②在 低溫低溫條件下(填“高溫”、“低溫”或“任何溫度”)能自
發進行。
(2)在密閉容器中投入足量的 MnCO3,在一定條件下發生反應:MnCO3(s)?MnO(s)+CO2(g)ΔH1=+116.6kJ/mol。一定溫度下,達到平衡狀態時p(CO2)=bMPa
①溫度、壓強對碳酸錳平衡分解率的影響如圖1所示。圖中Y1<<Y2(填“>”、“<”或“=”)。

②保持溫度不變,將體積擴大至原來的3倍,則容器內壓強p(CO2)的變化范圍為 b3MPa<p(CO2)≤bMPab3MPa<p(CO2)≤bMPa。
③若溫度不變,將容器體積壓縮至原來的一半,達到新平衡時,與原平衡狀態相比,下列物理量一定不變的是 D、ED、E (填字母)
A.CO2的質量 B.MnCO3的質量 C.MnCO3的分解率
D.化學平衡常數 E.CO2的物質的量濃度
(3)在4L恒容密閉容器中,充入足量的MnCO3(s)和a molO2(g),在一定溫度下發生反應:
MnCO3(s)+O2(g)?2MnO2(s)+2CO2(g),經過5min該反應剛好達到平衡狀態,且該段時間內CO2的化學反應速率為0.2mol?L-1?min-1若該條件該反應的化學平衡常數K=0.5,則a=1010。
(4)現以鉛蓄電池為電源,用石墨為電極,電解MnSO4和H2SO4混合液來制備MnO2,裝置如圖2所示,陽極的電極反應式為 Mn2+-2e-+2H2O═MnO2+4H+Mn2+-2e-+2H2O═MnO2+4H+,當蓄電池中有2mol H+被消耗時,則理論上能生成MnO28787g
b
3
MP
a
<
p
(
C
O
2
)
≤
b
MP
a
b
3
MP
a
<
p
(
C
O
2
)
≤
b
MP
a
【考點】反應熱和焓變.
【答案】-38.8kJ/mol;低溫;<;;D、E;10;Mn2+-2e-+2H2O═MnO2+4H+;87
b
3
MP
a
<
p
(
C
O
2
)
≤
b
MP
a
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/8/16 17:0:1組卷:87引用:3難度:0.1
相似題
-
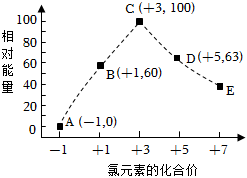 1.一定條件下,在水溶液中物質的量均為1mol的Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相對大小如圖所示。圖中最穩定的點為( )
1.一定條件下,在水溶液中物質的量均為1mol的Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相對大小如圖所示。圖中最穩定的點為( )A.A B.B C.C D.D 發布:2025/1/6 6:0:5組卷:0引用:1難度:0.9 -
2.下列與化學反應的能量變化有關的敘述正確的是( )
A.由石墨比金剛石穩定可知,C(金剛石)═C(石墨)△H<0 B.一個反應的反應物的總能量可能等于其生成物的總能量 C.有熱量變化的反應一定是化學反應 D.強酸與強堿的中和反應的熱化學方程式均可表示為H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ?mol-1 發布:2025/1/6 6:0:5組卷:1引用:3難度:0.6 -
3.下列說法不正確的是( )
A.CH3COOH 溶液加水稀釋后,溶液中 的值減小c(CH3COOH)c(CH3COO-)B.已知一定溫度下,醋酸溶液的物質的量濃度為c,電離度為α,Ka= .若加入少量醋酸鈉固體,則CH3COOH?CH3COO-+H+向左移動,α減小,Ka變小(cα)2c(1-α)C.實驗測得環己烷(l)、環己烯(l)和苯(l)的標準燃燒熱分別為-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以證明在苯分子中不存在獨立的碳碳雙鍵 D.已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g),△H=+489.0 kJ/mol.
CO(g)+O2(g)═CO2(g),△H=-283.0 kJ/mol.12
C(石墨)+O2(g)═CO2(g),△H=-393.5 kJ/mol.
則4Fe(s)+3O2(g)═2Fe2O3(s),△H=-1641.0 kJ/mol發布:2025/1/1 8:0:2組卷:11引用:1難度:0.7


