弱電解質的研究是重要課題。
(1)①已知不同pH條件下,水溶液中碳元素的存在形態如圖所示。下列說法不正確的是 cc。
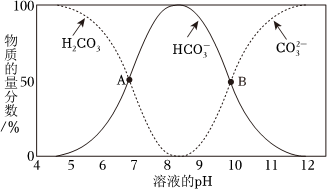
a.pH=8時,溶液中含碳元素的微粒主要是HCO-3
b.A點,溶液中H2CO3和HCO-3濃度相同
c.當c(HCO-3)=c(CO2-3)時,c(H+)>c(OH-)
d.該溫度下,H2CO3的第二步電離常數Ka2約為1×10-10
②向上述pH=8.4的水溶液中加入NaOH溶液時發生反應的離子方程式是 HCO-3+OH-=CO2-3+H2OHCO-3+OH-=CO2-3+H2O。
(2)已知在25℃時,醋酸、次氯酸、NH3?H2O、碳酸和亞硫酸的電離平衡常數分別為:
HC
O
-
3
HC
O
-
3
HC
O
-
3
C
O
2
-
3
HCO
-
3
CO
2
-
3
HCO
-
3
CO
2
-
3
| 電解質 | 醋酸 | 次氯酸 | NH3?H2O | 碳酸 | 亞硫酸 |
| 電離平衡常數 | K=1.75×10-5 | K=2.95×10-8 | K=1.8×10-5 | K1=4.0×10-7 K2=5.0×10-11 |
K1=1.54×10-2 K2=1.02×10-7 |
B
B
。A.少量CO2通入次氯酸鈉溶液中:CO2+H2O+ClO-=
HC
O
-
3
B.少量SO2通入次氯酸鈣溶液中:2ClO-+SO2+H2O=
S
O
2
-
3
C.Na2CO3溶液中加入足量NaHSO3溶液:
C
O
2
-
3
HS
O
-
3
HC
O
-
3
S
O
2
-
3
D.少量CO2通入亞硫酸鈉溶液中:
S
O
2
-
3
HS
O
-
3
HC
O
-
3
(3)如表是不同溫度下水的離子積數據:
| 溫度/℃ | 25 | t1 | t2 |
| 水的離子積Kw | 1×10-14 | a | 1×10-12 |
①若25<t1<t2,則a
>
>
1×10-14(填“>”“<”或“=”)。②25℃時,某Na2SO4溶液中c(
S
O
2
-
4
1000:1
1000:1
。③t2℃下,pH=2的HCl溶液與pH=5的H2SO4的溶液等體積混合后,混合溶液的pH=
2.3
2.3
。(已知lg2=0.3)④t2℃下,將pH=11的苛性鈉溶液V1L與pH=1的稀硫酸V2L混合(設混合后溶液的體積為原兩溶液體積之和),所得混合溶液的pH=2,則V1:V2=
9:11
9:11
。【答案】c;+OH-=+H2O;B;>;1000:1;2.3;9:11
HCO
-
3
CO
2
-
3
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/10/12 3:0:1組卷:19引用:2難度:0.6
相似題
-
1.25℃時,用蒸餾水稀釋0.10mol?L-1的醋酸,若用KW表示水的離子積常數,則下列各式表 示的數值隨水量的增加而增大的是( )
A. [CH3COOH][H+]B. [CH3COO-][CH3COOH]C. [H+]kWD. [H+][OH-]發布:2025/1/1 8:0:2組卷:1引用:1難度:0.7 -
2.用水稀釋0.1mol/L的醋酸溶液,其中隨加水量的增加而增大的有( )
A.C(CH3COOH) B.C(H+) C.C(H+)/C(CH3COOH) D.C(CH3COOH)/C(H+) 發布:2025/1/1 8:0:2組卷:3引用:1難度:0.9 -
3.將0.1mol?L-1的醋酸溶液加水稀釋,則( )
A.中和此溶液所需的0.1 mol?L-1 NaOH溶液的體積增加 B.c(CH3COOH)減小,平衡向電離方向移動,c(CH3COO-)增大 C.平衡向電離方向移動,c(CH3COOH)、c(H+)、c(OH-)、c(CH3COO-)均減小 D.電離程度增大,由CH3COOH電離出的n(H+)變大 發布:2025/1/1 8:0:2組卷:6引用:1難度:0.7


