2023-2024學年寧夏銀川一中高二(上)期中化學試卷
發布:2024/10/12 3:0:1
一、選擇題(每小題只有一個正確答案,每小題2分,共50分)
-
1.下列屬于弱電解質的是( )
A.酒精 B.冰醋酸 C.氨水 D.CO2 組卷:12引用:2難度:0.6 -
2.下列方程式書寫正確的是( )
A. 在水溶液中的電離方程式:HCO-3+H2O?H3O++HCO-3CO2-3B.H2SO3的電離方程式:H2SO3?2H++ SO2-3C.NH3?H2O的電離方程式:NH3?H2O= +OH-NH+4D.Fe(OH)3膠體的制備:Fe3++3H2O=Fe(OH)3↓+3H+ 組卷:15引用:2難度:0.5 -
3.下列溶液一定呈中性的是( )
A.pH=7的溶液 B.c(H+)= 的溶液KwC.由強酸、強堿等物質的量反應得到的溶液 D.非電解質溶于水得到的溶液 組卷:117引用:4難度:0.7 -
4.下列說法正確的是( )
A.自發反應在任何條件下都能實現 B.所有的自發反應不一定都是放熱的 C.增大濃度,活化分子百分數增大,化學反應速率增大 D.一般使用催化劑可以降低反應的活化能,增大活化分子百分數,提高反應物的平衡轉化率 組卷:13引用:2難度:0.5 -
5.下列有關熱化學方程式的敘述正確的是( )
A.已知:2H2(g)+O2(g)═2H2O(g)ΔH=-483.6kJ/mol,則氫氣的燃燒熱為241.8 kJ/mol B.已知:S(g)+O2(g)═SO2(g)ΔH1;S(s)+O2(g)═SO2(g)ΔH2,則ΔH1>ΔH2 C.已知:N2(g)+3H2(g)?2NH3(g)ΔH=-92kJ/mol,增加氮氣和氫氣的用量,則ΔH變小 D.在稀溶液中,H+(aq)+OH-(aq)═H2O(1)ΔH=-57.3kJ/mol,若將1molNaOH固體的加入1L1mol/L的稀鹽酸溶液中,放出的熱量大于57.3kJ 組卷:49引用:5難度:0.5 -
6.某小組用25.00mL0.50mol/NaOH溶液和25.00mL0.50mol/L硫酸溶液進行反應熱的測定,實驗測得中和熱的ΔH=-53.5kJ/mol。該值與理論值產生偏差的原因不可能是( )
A.實驗裝置保溫、隔熱效果差 B.量取NaOH溶液的體積時仰視讀數 C.分多次把NaOH溶液倒入盛有硫酸的小燒杯中 D.用溫度計測定NaOH溶液起始溫度后直接測定H2SO4溶液的溫度 組卷:44引用:5難度:0.7 -
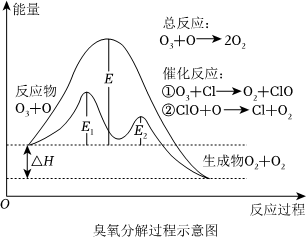 7.臭氧分解過程如圖所示,下列說法正確的是( )
7.臭氧分解過程如圖所示,下列說法正確的是( )A.催化反應①②均為放熱反應 B.決定O3分解反應速率的是催化反應② C.E1是催化反應①對應的正反應的活化能,(E2+ΔH)是催化反應②對應的逆反應的活化能 D.溫度升高,總反應的正反應速率增加,逆反應速率減小 組卷:32引用:4難度:0.7 -
8.CO2加氫制CH4的一種催化機理如圖所示,下列說法正確的是( )

A.反應中La2O3是中間產物 B.反應中La2O2CO3可以釋放出帶負電荷的CO2? C.H2經過Ni 活性中心裂解產生活化態H?的過程中ΔS>0 D.使用TiO2作催化劑可以降低反應的焓變,從而提高化學反應速率 組卷:7引用:2難度:0.7 -
9.下列對化學反應預測正確的是( )
選項 化學反應方程式 已知條件 預測 A W(s)+xG(g)=2Q(g) ΔH<0,自發反應 x可能等于1、2、3 B M(s)=X(g)+Y(s) ΔH>0 它是非自發反應 C 4X(g)+5Y(g)=4W(g)+6G(g) 能自發反應 ΔH一定小于0 D 4M(s)+N(g)+2W(l)=4Q(s) 常溫下,自發進行 ΔH>0 A.A B.B C.C D.D 組卷:21引用:1難度:0.8
二、非選擇題(本大題共4小題,共50分)
-
28.Ⅰ.黨的二十大報告提出未來我國將用更高的標準深入打好污染物防治攻堅戰,統籌減污降碳,所以深入研究碳、氮元素的物質轉化有著重要的實際意義。
(1)已知合成尿素的反應分兩步進行:
2NH3(g)+CO2(g)?NH2COONH4(s)ΔH1化學平衡常數K1
NH2COONH4(s)?CO(NH2)2(s)+H2O(g)ΔH2化學平衡常數K2
①若向某恒溫且恒容的密閉容器中加入等物質的量的NH3和CO2,發生上述反應。下列敘述不能說明反應已經達到平衡狀態的是(填標號)。
A.斷裂6molN-H鍵的同時斷裂2molO-H鍵
B.壓強不再變化
C.混合氣體的密度不再變化
D.CO2的體積分數不再變化
②反應CO(NH2)2(s)+H2O(g)?2NH3(g)+CO2(g)的化學平衡常數K=(用含K1、K2的代數式表示)。
Ⅱ.氨氣中氫含量高,是一種優良的小分子儲氫載體,且安全、易儲運,可通過下面兩種方法由氨氣得到氫氣。
方法I:氨熱分解法制氫氣相關化學鍵的鍵能數據一定溫度下,利用催化劑將NH3分解為N2和H2.回答下列問題:化學鍵 N≡N H-H N-H 鍵能E/(kJ?mol-1) 946 436.0 390.8
(2)反應2NH3(g)?N2(g)+3H2(g)ΔH=kJ/mol;
(3)已知該反應的ΔS=198.9J?mol-1?K-1,在下列哪些溫度下反應能自發進行?(填標號)
A.25℃
B.125℃
C.225℃
D.325℃
(4)某興趣小組對該反應進行了實驗探究。在一定溫度和催化劑的條件下,將0.1molNH3通入3L的密閉容器中進行反應(此時容器內總壓為200kPa),各物質的分壓隨時間的變化曲線如圖所示。
①t2時將容器體積迅速縮小至原來的一半并保持不變,圖中能正確表示壓縮后N2分壓變化趨勢的曲線是(用圖中a、b、c、d表示);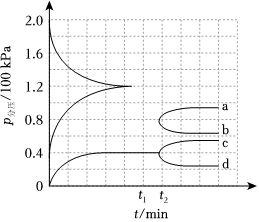
②在該溫度下,反應的標準平衡常數KΘ=。(已知:分壓=總壓×該組分物質的量分數,對于反應dD(g)+eE(g)?gG(g)+hH(g),KΘ=,其中pΘ=100kPa,pG、pH、pD、pE為各組分的平衡分壓)。(pGpΘ)g?(pHpΘ)h(pDpΘ)d?(pEpΘ)e
(5)一種脫除和利用水煤氣中CO2方法的示意圖如圖: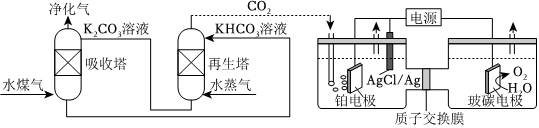
某溫度下,吸收塔中K2CO3溶液吸收一定量的CO2后,c():c(CO2-3)=1:2,則該溶液的pH=HCO-3(該溫度下H2CO3的Ka1=4.6×10-7,Ka2=5.0×10-11)。組卷:19引用:2難度:0.5 -
29.弱電解質的研究是重要課題。
(1)①已知不同pH條件下,水溶液中碳元素的存在形態如圖所示。下列說法不正確的是。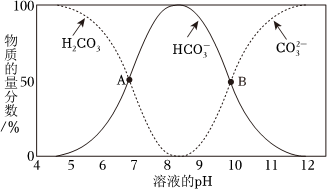
a.pH=8時,溶液中含碳元素的微粒主要是HCO-3
b.A點,溶液中H2CO3和濃度相同HCO-3
c.當c()=c(HCO-3)時,c(H+)>c(OH-)CO2-3
d.該溫度下,H2CO3的第二步電離常數Ka2約為1×10-10
②向上述pH=8.4的水溶液中加入NaOH溶液時發生反應的離子方程式是。
(2)已知在25℃時,醋酸、次氯酸、NH3?H2O、碳酸和亞硫酸的電離平衡常數分別為:
下列離子方程式中錯誤的是電解質 醋酸 次氯酸 NH3?H2O 碳酸 亞硫酸 電離平衡常數 K=1.75×10-5 K=2.95×10-8 K=1.8×10-5 K1=4.0×10-7
K2=5.0×10-11K1=1.54×10-2
K2=1.02×10-7。
A.少量CO2通入次氯酸鈉溶液中:CO2+H2O+ClO-=+HClOHCO-3
B.少量SO2通入次氯酸鈣溶液中:2ClO-+SO2+H2O=+2HClOSO2-3
C.Na2CO3溶液中加入足量NaHSO3溶液:+CO2-3=HSO-3+HCO-3SO2-3
D.少量CO2通入亞硫酸鈉溶液中:+CO2+H2O=SO2-3+HSO-3HCO-3
(3)如表是不同溫度下水的離子積數據:
試回答以下問題:溫度/℃ 25 t1 t2 水的離子積Kw 1×10-14 a 1×10-12
①若25<t1<t2,則a1×10-14(填“>”“<”或“=”)。
②25℃時,某Na2SO4溶液中c()=5×10-4mol?L-1,取該溶液1mL加水稀釋至10mL,則稀釋后溶液中c(Na+):c(OH-)=SO2-4。
③t2℃下,pH=2的HCl溶液與pH=5的H2SO4的溶液等體積混合后,混合溶液的pH=。(已知lg2=0.3)
④t2℃下,將pH=11的苛性鈉溶液V1L與pH=1的稀硫酸V2L混合(設混合后溶液的體積為原兩溶液體積之和),所得混合溶液的pH=2,則V1:V2=。組卷:19引用:2難度:0.6


