 25℃時,部分物質的電離平衡常數如下表所示。
25℃時,部分物質的電離平衡常數如下表所示。
| 化學式 | CH3COOH | H2CO3 | HClO |
| 電離平衡常數 | 1.7×10-5 | K1=4.3X10-7 K2=5.6X10-11 |
3.0×10-8 |
(1)CH3COOH、H2CO3、HClO、HCO3-的酸性最強的是
CH3COOH
CH3COOH
,最弱的是HCO3-
HCO3-
。(2)同濃度的CH3COO-、HCO3-、CO32-、ClO-水解能力最強的是
CO32-
CO32-
。(3)常溫下0.1mol?L-1的CH3COOH溶液在加水稀釋過程中,下列表達式的數據一定變小的是
AD
AD
。(填字母序號,下同)A.c(H+)
B.
c
(
H
+
)
c
(
C
H
3
COOH
)
C.c(H+)?c(OH-)
D.
c
(
O
H
-
)
c
(
H
+
)
E.
c
(
C
H
3
CO
O
-
)
?
c
(
H
+
)
c
(
C
H
3
COOH
)
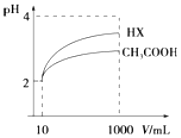
(4)體積為10mL pH=2的醋酸溶液與一元酸HX溶液分別加水稀釋至1000mL,稀釋過程pH變化如圖。則HX屬于
弱酸
弱酸
。(填“強酸”、“弱酸”)(5)明礬可用于做自來水凈水劑,化學式KAl(SO4)2?12H2O,其溶液顯
酸性
酸性
(填“酸性”、“堿性”“中性”),原因是Al3++3H2O?Al(OH)3+3H+
Al3++3H2O?Al(OH)3+3H+
(用離子方程式表示)。該溶液中各離子濃度大小關系式為c(SO42-)>c(K+)>c(Al3+)>c(H+)>c(OH-)
c(SO42-)>c(K+)>c(Al3+)>c(H+)>c(OH-)
。【考點】弱電解質的電離平衡.
【答案】CH3COOH;HCO3-;CO32-;AD;弱酸;酸性;Al3++3H2O?Al(OH)3+3H+;c(SO42-)>c(K+)>c(Al3+)>c(H+)>c(OH-)
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:20引用:1難度:0.6
相似題
-
1.用水稀釋0.1mol/L的醋酸溶液,其中隨加水量的增加而增大的有( )
A.C(CH3COOH) B.C(H+) C.C(H+)/C(CH3COOH) D.C(CH3COOH)/C(H+) 發布:2025/1/1 8:0:2組卷:3引用:1難度:0.9 -
2.25℃時,用蒸餾水稀釋0.10mol?L-1的醋酸,若用KW表示水的離子積常數,則下列各式表 示的數值隨水量的增加而增大的是( )
A. [CH3COOH][H+]B. [CH3COO-][CH3COOH]C. [H+]kWD. [H+][OH-]發布:2025/1/1 8:0:2組卷:1引用:1難度:0.7 -
3.將0.1mol?L-1的醋酸溶液加水稀釋,則( )
A.中和此溶液所需的0.1 mol?L-1 NaOH溶液的體積增加 B.c(CH3COOH)減小,平衡向電離方向移動,c(CH3COO-)增大 C.平衡向電離方向移動,c(CH3COOH)、c(H+)、c(OH-)、c(CH3COO-)均減小 D.電離程度增大,由CH3COOH電離出的n(H+)變大 發布:2025/1/1 8:0:2組卷:6引用:1難度:0.7


