2020-2021學年廣西梧州市蒙山中學高二(下)月考化學試卷
發布:2024/4/20 14:35:0
一、單項選擇題(每題2分,共40分)
-
1.反應A(g)+3B(g)?2C(g)△H<0達平衡后,將反應體系的溫度降低,下列敘述中正確的是( )
A.正反應速率增大,逆反應速率減小,平衡向正反應方向移動 B.正反應速率增大,逆反應速率減小,平衡向逆反應方向移動 C.正反應速率和逆反應速率都變小,平衡向正反應方向移動 D.正反應速率和逆反應速率都變小,平衡向逆反應方向移 組卷:26引用:5難度:0.5 -
2.已知化學反應2A(?)+B(g)?2C(?)達到平衡,當增大壓強時,平衡向逆反應反向移動,則下列情況可能是( )
A.A是氣體,C是固體 B.A,C均為氣體 C.A,C均為固體 D.A是固體,C是氣體 組卷:67引用:18難度:0.9 -
3.下列物質分類正確的是( )
A B C D 強電解質 HCl FeCl3 H3PO4 Ca(OH)2 弱電解質 HF CH3COOH BaSO4 HNO3 非電解質 NH3 Cu H2O C2H5OH A.A B.B C.C D.D 組卷:75引用:3難度:0.6 -
4.下列式子屬于水解反應,且其相應溶液呈酸性的是( )
A.HCO3-+H2O?H3O++CO32- B.Fe3++3H2O?Fe(OH)3+3H+ C.ClO-+H2O?HClO+OH- D.H2S+H2O?HS-+H3O+ 組卷:149引用:4難度:0.7 -
5.下列事實一定能證明HNO2是弱電解質的是( )
①常溫下HNO2溶液的pH小于7
②用HNO2溶液做導電實驗,燈泡很暗
③HNO2和NaCl不能發生反應
④0.1mol/L HNO2溶液的pH=2.1
⑤NaNO2和H3PO4反應,生成HNO2
⑥pH=1的 HNO2溶液稀釋至100倍,pH約為2.8A.①④⑤⑥ B.④⑤⑥ C.①②③④ D.全部 組卷:87引用:2難度:0.6 -
6.已知下面三個數據:7.2×10-4、4.6×10-4、4.9×10-10分別是下列有關的三種酸的電離常數,若已知下列反應可以發生:NaCN+HNO2═HCN+NaNO2NaCN+HF═HCN+NaF NaNO2+HF═HNO2+NaF.由此可判斷下列敘述中不正確的是( )
A.K(HF)=7.2×10-4 B.K(HNO2)=4.9×10-10 C.根據兩個反應即可得出一元弱酸的強弱順序為HF>HNO2>HCN D.K(HCN)<K(HNO2)<K(HF) 組卷:29引用:11難度:0.9 -
7.下面提到的問題中,與鹽的水解無關的是( )
A.NH4Cl與ZnCl2溶液可作焊接中的除銹劑 B.將FeCl3溶液蒸干灼燒,所得固體為Fe2O3 C.使用泡沫滅火器時,使硫酸鋁和小蘇打溶液混合 D.為保存FeCl2溶液,要在溶液中加少量鐵粉 組卷:45引用:1難度:0.7 -
8.將硝酸鋁溶液和硫酸鋁溶液分別蒸干、灼燒,最后得到的固體是( )
A.都是Al2O3 B.依次為AlCl3、Al2(SO4)3 C.都是Al(OH)3 D.依次為Al2O3、Al2(SO4)3 組卷:40引用:1難度:0.7
二、解答題(共4小題,滿分60分)
-
 23.25℃時,部分物質的電離平衡常數如下表所示。
23.25℃時,部分物質的電離平衡常數如下表所示。
請回答下列問題:化學式 CH3COOH H2CO3 HClO 電離平衡常數 1.7×10-5 K1=4.3X10-7
K2=5.6X10-113.0×10-8
(1)CH3COOH、H2CO3、HClO、HCO3-的酸性最強的是,最弱的是。
(2)同濃度的CH3COO-、HCO3-、CO32-、ClO-水解能力最強的是。
(3)常溫下0.1mol?L-1的CH3COOH溶液在加水稀釋過程中,下列表達式的數據一定變小的是。(填字母序號,下同)
A.c(H+)
B.c(H+)c(CH3COOH)
C.c(H+)?c(OH-)
D.c(OH-)c(H+)
E.c(CH3COO-)?c(H+)c(CH3COOH)
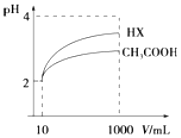
(4)體積為10mL pH=2的醋酸溶液與一元酸HX溶液分別加水稀釋至1000mL,稀釋過程pH變化如圖。則HX屬于。(填“強酸”、“弱酸”)
(5)明礬可用于做自來水凈水劑,化學式KAl(SO4)2?12H2O,其溶液顯(填“酸性”、“堿性”“中性”),原因是(用離子方程式表示)。該溶液中各離子濃度大小關系式為。組卷:20引用:1難度:0.6 -
24.軟錳礦的主要成分為MnO2,還含有Fe2O3、MgO、Al2O3、CaO、SiO2等雜質,工業上用軟錳礦制取MnSO4?H2O的流程如圖。
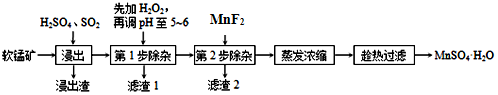
(1)“浸出”時所加的X酸是(填化學式),浸出渣的主要成分為(填化學式)。為了提高浸出速率,可采取哪些措施、?(回答兩點)。
(2)浸出過程中MnO2轉化為Mn2+的離子方程式為。
(3)第1步除雜,加過氧化氫的作用是,該反應的離子反應方程式為。第2步除雜,主要將Ca2+、Mg2+轉化為相應氟化物沉淀除去,寫出MnF2除去Mg2+的離子反應方程式:。(已知:MnF2的Ksp=5.6×10-3;MgF2的Ksp=8.0×10-11)。該反應的平衡常數K=。
(4)取少量MnSO4?H2O溶于水,配成溶液,測其pH發現該溶液顯酸性,原因是。(用離子方程式表示)組卷:11引用:1難度:0.5


