空氣中的氧氣含量測定再認識。
實驗過程如下:
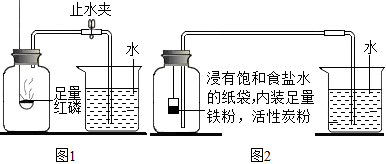
A.在實際容積為230mL的集氣瓶里,先裝進30mL的水,用止水夾夾緊橡皮管;
B.點燃燃燒匙內(nèi)的紅磷,觀察到紅磷燃燒,立即伸入瓶中并塞緊瓶塞;
C.等裝置冷卻至室溫后,打開止水夾。
(1)實驗原理:由于紅磷燃燒消耗空氣中的氧氣,使瓶內(nèi) 氣壓氣壓減小,燒杯中水倒吸到集氣瓶,進入水的體積即為氧氣的體積。紅磷燃燒的文字表達式為 紅磷+氧氣點燃五氧化二磷紅磷+氧氣點燃五氧化二磷。
(2)紅磷燃燒的主要現(xiàn)象是 劇烈燃燒,產(chǎn)生白煙,放熱劇烈燃燒,產(chǎn)生白煙,放熱。若實驗非常成功,紅磷熄滅后,待裝置冷卻至室溫,打開止水夾,觀察到燒杯中的水倒吸入集氣瓶,最終集氣瓶中水的總體積約為 7070mL。實際觀察水面的變化情況發(fā)現(xiàn),集氣瓶內(nèi)上升的水面小于瓶內(nèi)原有氣體體積的五分之一,可能的原因是:紅磷不足或裝置漏氣等紅磷不足或裝置漏氣等(寫一種即可)。
(3)上面的實驗同時證明了氮氣 難難(填“易”或“難”)溶于水和化學性質(zhì) 不活潑不活潑(填“活潑”或“不活潑”)的結(jié)論。
【查閱資料】
燃燒過程中,當氧氣體積分數(shù)低于8.8%時,紅磷就無法繼續(xù)燃燒,因此通過上述實驗測定空氣中氧氣的含量,測定結(jié)果與理論值誤差較大。
【實驗改進】
(一)根據(jù)鐵在空氣中生銹的原理設(shè)計如圖2實驗裝置,再次測定空氣中氧氣含量。鐵生銹是緩慢氧化,對氧氣濃度要求小。(提示:鐵生銹會消耗空氣中的氧氣和水蒸氣,裝置中飽和食鹽水、活性炭會加速鐵生銹。)
(二)測得實驗數(shù)據(jù)如下:
點燃
點燃
| 實驗前 | 實驗后 |
| 燒杯中的水的體積 | 燒杯中剩余水的體積 |
| 80.0mL | 54.5mL |
(4)根據(jù)測得實驗數(shù)據(jù)計算:進入集氣瓶中水的體積是
25.5
25.5
mL,改進實驗后測得的空氣中氧氣的體積分數(shù)是 20.2%
20.2%
(計算結(jié)果精確到0.1%)。(5)對比兩個實驗,你覺得改進后實驗的優(yōu)點有
能將集氣瓶中的氧氣消耗更徹底,使實驗結(jié)果更準確或測量時考慮到導管容積和扣除內(nèi)容物后的集氣瓶容積,使實驗結(jié)果更準確
能將集氣瓶中的氧氣消耗更徹底,使實驗結(jié)果更準確或測量時考慮到導管容積和扣除內(nèi)容物后的集氣瓶容積,使實驗結(jié)果更準確
(寫一點)。(6)丁同學設(shè)想用圖1裝置,換用鐵粉和活性炭(主要成分碳)代替紅磷將其燃燒,進行氧氣含量的測定,你認為是否可行
不行
不行
(填“可行”或“不行”)。理由:鐵在空氣中不能燃燒,且碳燃燒生成二氧化碳,二氧化碳是氣體,化學反應(yīng)前后,壓強變化不大,冷卻后,燒杯中的水不能進入集氣瓶,無法測定空氣中氧氣含量
鐵在空氣中不能燃燒,且碳燃燒生成二氧化碳,二氧化碳是氣體,化學反應(yīng)前后,壓強變化不大,冷卻后,燒杯中的水不能進入集氣瓶,無法測定空氣中氧氣含量
。【考點】測定空氣里氧氣含量的探究.
【答案】氣壓;紅磷+氧氣五氧化二磷;劇烈燃燒,產(chǎn)生白煙,放熱;70;紅磷不足或裝置漏氣等;難;不活潑;25.5;20.2%;能將集氣瓶中的氧氣消耗更徹底,使實驗結(jié)果更準確或測量時考慮到導管容積和扣除內(nèi)容物后的集氣瓶容積,使實驗結(jié)果更準確;不行;鐵在空氣中不能燃燒,且碳燃燒生成二氧化碳,二氧化碳是氣體,化學反應(yīng)前后,壓強變化不大,冷卻后,燒杯中的水不能進入集氣瓶,無法測定空氣中氧氣含量
點燃
【解答】
【點評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:30引用:1難度:0.3
相似題
-
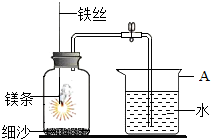 1.某校研究性學習小組用如圖所示裝置進行鎂條在空氣中燃燒的實驗。待鎂條完全燃燒并冷卻后打開彈簧夾,進入集氣瓶中水的體積約占集氣瓶容積的70%。
1.某校研究性學習小組用如圖所示裝置進行鎂條在空氣中燃燒的實驗。待鎂條完全燃燒并冷卻后打開彈簧夾,進入集氣瓶中水的體積約占集氣瓶容積的70%。
(1)圖中A儀器的名稱是。鎂條燃燒并冷卻后打開彈簧夾,水能進入到集氣瓶中的原因是。
(2)如果鎂條只和空氣中的氧氣反應(yīng),則進入集氣瓶中水的體積最多不超過其容積的%.現(xiàn)進入集氣瓶中水的體積約為其容積的70%,根據(jù)空氣的組成可推出減少的氣體中有氮氣。
【發(fā)現(xiàn)問題】氮氣是如何減少的?
【做出猜想】。
【查閱資料】鎂條在氮氣中能燃燒,產(chǎn)物為氮化鎂(Mg3N2)固體。氮化化鎂中氮的化合價是。鎂條還可以在二氧化碳氣體中燃燒生成碳和氧化鎂,反應(yīng)的化學方程式為2Mg+CO2C+2MgO,該反應(yīng)所的基本反應(yīng)類型是點燃。
(3)通過以上探究,你對燃燒的有關(guān)知識有了哪些新的認識?(寫出一條即可)
(4)24g鎂在二氧化碳中燃燒可生成多少克氧化鎂?發(fā)布:2024/11/18 8:0:1組卷:13引用:1難度:0.5 -
2.如圖1是某化學興趣小組利用氣壓傳感器測定紅磷燃燒時集氣瓶內(nèi)氣壓變化的實驗裝置。圖2是集氣瓶內(nèi)氣壓隨時間的變化情況。下列說法不正確的是( )
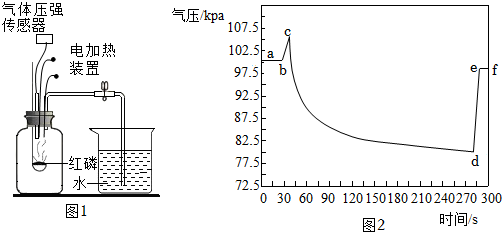
A.bc段氣壓增大的主要原因是紅磷燃燒放熱 B.cd段氣壓減小的主要原因是集氣瓶內(nèi)氧氣不斷被消耗 C.紅磷熄滅后,若立即打開止水夾會導致測得的結(jié)果小于 15D.若用木炭代替紅磷,集氣瓶內(nèi)氣壓變化趨勢與圖2基本一致 發(fā)布:2024/12/25 11:30:2組卷:1085引用:3難度:0.7 -
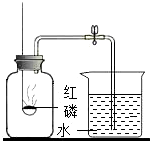 3.測定空氣里氧氣的含量,甲、乙、丙三個同學用如圖所示的裝置分別進行了實驗探究。
3.測定空氣里氧氣的含量,甲、乙、丙三個同學用如圖所示的裝置分別進行了實驗探究。
(1)實驗時,取下橡膠塞,點燃紅磷后迅速伸入集氣瓶中并旋緊橡膠塞,這時看到的現(xiàn)象是,該反應(yīng)的文字表達式為。
(2)甲同學:用足量的木炭代替紅磷做測定空氣中氧氣含量的實驗,結(jié)果實驗失敗了,請你幫助他分析失敗的原因:。
(3)乙同學:想用鎂條來代替紅磷做實驗,老師告訴他這種方法不是較好的方法,因為鎂條在空氣中燃燒非常劇烈,鎂既可以和氧氣反應(yīng),也可以和氮氣反應(yīng)生成氮化鎂。請寫出鎂和氮氣反應(yīng)生成氮化鎂的文字表達式:。
(4)丙同學:打算用鐵絲替代紅磷,實驗?zāi)芊癯晒Γ空堈f明理由。。
(5)燃燒后,集氣瓶內(nèi)剩余的氣體主要是氮氣,請結(jié)合本實驗推測氮氣的物理性質(zhì)是。發(fā)布:2024/11/7 8:0:2組卷:19引用:1難度:0.5
相關(guān)試卷


