當前位置:
試題詳情
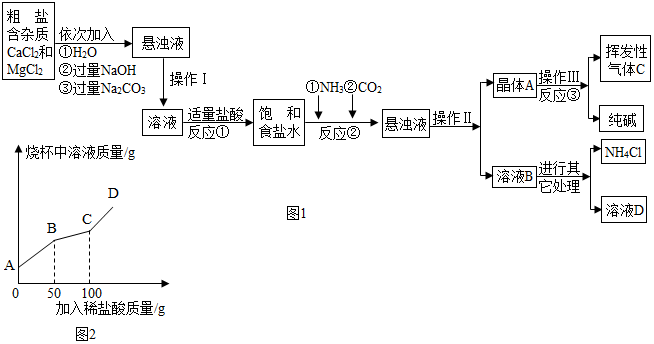
某校化學興趣小組參觀制堿廠后,獲得以下信息并對相關問題進行研究。
【產品與原理】該廠采用“侯氏制堿法”生產化工產品--純堿(Na2CO3)和化肥NH4Cl。
生產原理是:將NH3和CO2通入飽和食鹽水中得到NaHCO3和NH4Cl的混合物,反應為:NaCl(飽和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl;分離出NaHCO3晶體,加熱制得純堿。
【生產流程】
【相關資料】
(1)NH4Cl △ NH3↑+HCl↑
(2)已知20℃時有關物質的溶解度如下(氣體指1體積水中能溶解的氣體體積)
△
| 物質 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
(1)氨堿工業最關鍵的一步是:在加壓的條件下不斷向飽和的氨鹽水中通入二氧化碳氣體,溶液中會有碳酸氫鈉晶體析出。試分析該流程需要加壓條件的原因是:
增大CO2的溶解度
增大CO2的溶解度
。流程中加入過量氫氧化鈉目的是除去雜質氯化鎂
除去雜質氯化鎂
。操作Ⅱ的名稱叫過濾
過濾
。(2)反應①中發生了兩個反應,寫出其中的一個化學方程式:
NaOH+HCl═NaCl+H2O
NaOH+HCl═NaCl+H2O
。(3)反應③中得到純堿的化學方程式為:
2NaHCO3 Na2CO3+H2O+CO2↑
△
2NaHCO3 Na2CO3+H2O+CO2↑
。 △
(4)上述生產流程中可循環使用的是
AB
AB
(填序號)。A.氣體C B.溶液D C.氫氧化鎂 D.化肥NH4Cl
(5)在氨堿工業處理剩余的氯化銨溶液時。為何不直接蒸發結晶析出氯化銨固體?
氯化銨受熱易分解
氯化銨受熱易分解
。【組成確定】
(6)稱取一定質量的純堿樣品,經多次充分加熱后,再稱重,質量無變化,則樣品中已無
NaHCO3
NaHCO3
(寫化學式)。(7)另取少量純堿樣品加入適量水,樣品完全溶解,向該溶液中加入過量稀HNO3,再滴加AgNO3溶液,有白色沉淀。由上述實驗可確定純堿樣品含有雜質
NaCl
NaCl
(寫化學式)。(8)某研究性學習小組對剛生產出的純堿產品進行檢測。取22克該樣品于燒杯中,加水將其溶解,然后逐滴加入溶質質量分數為14.6%的稀鹽酸并不斷振蕩。
首先發生的反應是:Na2CO3+HCl=NaHCO3+NaCl;
然后發生的反應是:NaHCO3+HCl=NaCl+H2O+CO2↑;
在上述過程中燒杯中溶液質量與加入稀鹽酸質量的關系如圖2所示。
請你根據圖甲提供的信息,計算出反應產生的二氧化碳的質量
8.8g
8.8g
;計算該樣品中純堿的質量分數96.4%
96.4%
(計算結果用百分數表示,保留到小數點后一位)【答案】增大CO2的溶解度;除去雜質氯化鎂;過濾;NaOH+HCl═NaCl+H2O;2NaHCO3 Na2CO3+H2O+CO2↑;AB;氯化銨受熱易分解;NaHCO3;NaCl;8.8g;96.4%
△
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/11/3 8:0:2組卷:149引用:1難度:0.5
相似題
-
1.侯德榜是我國著名的化學家,為純堿和氮肥工業技術的發展作出了杰出的貢獻,他發明的侯氏制堿法大大提高了原料的利用率,其工業流程大致如圖:
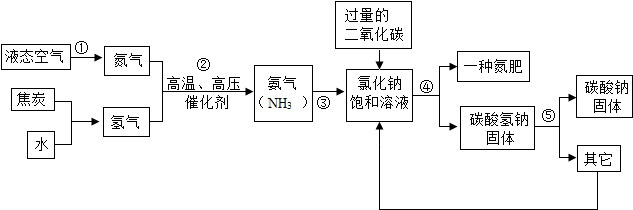
(1)上述流程中,用到的原料有空氣、焦炭、水、二氧化碳以及。
(2)若上述流程中,“一種氮肥”指的是一種銨態氮肥,則其化學式是。
(3)上述流程中,為了節約成本,可循環利用的物質是。發布:2024/11/15 8:0:2組卷:147引用:2難度:0.5 -
2.侯德榜是我國著名的化學家,為純堿和氮肥工業技術的發展做出了杰出的貢獻,他發明的侯氏制堿法大大提高了原料的利用率,其工藝流程大致如下圖所示:

(1)上述流程中,用到的原料有空氣、焦炭、水、二氧化碳、等;
(2)上述流程中,可循環利用的物質是;
(3)上述流程中,“一種氮肥”的化學式是。發布:2024/11/15 8:0:2組卷:22引用:1難度:0.5 -
3.海洋是人類寶貴的自然資源,海水“曬鹽”和海水“制堿”體現了人類利用和改造自然的智慧,請根據粗鹽“制堿”的流程圖(如圖)回答問題:
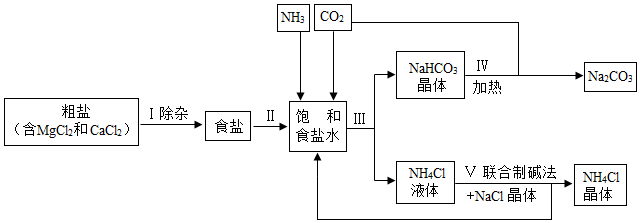
(1)步驟Ⅰ除雜中,常見的方法有兩種:一是物理方法,即用NaCl溶液浸洗粗鹽,溶解除去其中的可溶性雜質,則浸洗溶液應選用NaCl的(填“飽和”或“不飽和”)溶液;二是化學方法,操作步驟依次為:加水溶解→加過量試劑①→加過量試劑②→過濾→加適量鹽酸,以下試劑①②組合選用合理的是。
A.①Ca(OH)2②Na2CO3
B.①Na2CO3②Ca(OH)2
C.①KOH②Na2CO3
D.①NaOH②Na2CO3
(2)步驟Ⅲ先向飽和食鹽水中通入氨氣,再通入二氧化碳,這樣做的目的是,寫出步驟Ⅲ反應的化學方程式。
(3)步驟Ⅳ發生的反應屬于反應(填基本反應類型)。
(4)我國化學家侯德榜創立的聯合制堿法的優點有。
A.無“索爾維氨堿法”中的廢棄物CaCl2生成,有利于保護環境
B.大大提高了食鹽的利用率,節約了成本
C.將“制堿”與制氨生產聯合起來,同時析出的NH4Cl晶體可用作復合肥發布:2024/12/24 10:30:2組卷:555引用:9難度:0.5


