 向200mL某物質的量濃度的NaOH溶液中緩慢通入一定量的CO2,充分反應,測得最后溶液的pH>7.
向200mL某物質的量濃度的NaOH溶液中緩慢通入一定量的CO2,充分反應,測得最后溶液的pH>7.
(1)此時溶液的溶質如果是單一成分,可能是Na2CO3或NaHCO3Na2CO3或NaHCO3;如果是多種成分,可能是NaOH和Na2CO3或Na2CO3和NaHCO3NaOH和Na2CO3或Na2CO3和NaHCO3.
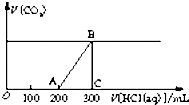
(2)在上述所得溶液中,逐滴緩慢滴加2mol?L-1的鹽酸,所得氣體(不考慮溶解于水)的體積與所加鹽酸的體積關系如圖所示:
①加入鹽酸200mL之前,無氣體產生,寫出OA段發生反應的離子方程式OH-+H+═H2O、CO32-+H+═HCO3-OH-+H+═H2O、CO32-+H+═HCO3-.
②B點時,反應所得溶液中溶質的物質的量濃度是1.2 mol?L-11.2 mol?L-1(溶液體積的變化忽略不計).
【考點】離子方程式的有關計算;離子方程式的書寫.
【答案】Na2CO3或NaHCO3;NaOH和Na2CO3或Na2CO3和NaHCO3;OH-+H+═H2O、CO32-+H+═HCO3-;1.2 mol?L-1
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:133引用:9難度:0.3
相似題
-
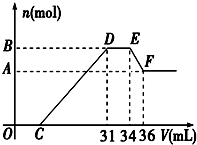 1.已知硝酸與金屬發生氧化還原反應的時候,一般硝酸濃度越稀,對應的還原產物中氮的化合價越低.現有一定量的鋁、鐵合金與一定量稀HNO3充分反應,反應過程中無任何氣體放出.在反應結束后的溶液中,逐滴加入4mol/L NaOH溶液,所加NaOH溶液的體積(V)與產生沉淀的物質的量(n)關系如圖所示.則:
1.已知硝酸與金屬發生氧化還原反應的時候,一般硝酸濃度越稀,對應的還原產物中氮的化合價越低.現有一定量的鋁、鐵合金與一定量稀HNO3充分反應,反應過程中無任何氣體放出.在反應結束后的溶液中,逐滴加入4mol/L NaOH溶液,所加NaOH溶液的體積(V)與產生沉淀的物質的量(n)關系如圖所示.則:
(1)試寫出DE段、EF段所發生反應的離子方程式:
DE段EF段
(2)合金中鋁的物質的量為mol
(3)合金中金屬的物質的量共為mol
(4)求出C點的值為ml.發布:2024/11/18 8:0:1組卷:18引用:1難度:0.3 -
2.用1L 1.0mol/LNaOH溶液吸收0.8molCO2,所得溶液中的
和CO2-3的物質的量濃度之比約是( )HCO-3A.2:3 B.1:2 C.1:3 D.3:2 發布:2024/12/3 7:30:1組卷:83引用:6難度:0.7 -
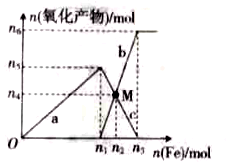 3.在1L 2mol?L-1稀硝酸溶液中逐漸加入鐵粉,反應中氧化產物的物質的量與加入鐵粉的物質的量的關系如圖所示。回答下列問題:
3.在1L 2mol?L-1稀硝酸溶液中逐漸加入鐵粉,反應中氧化產物的物質的量與加入鐵粉的物質的量的關系如圖所示。回答下列問題:
(1)與曲線a對應的離子方程式為。
(2)曲線b代表的微粒為;n2的值為。
(3)若M點時再加入VL2mol?L-1的稀硝酸,恰好反應完全,則V為。
(4)研究表明硝酸的濃度越小,反應后氮的化合價越低。在極稀的硝酸溶液中加入少量鐵粉,生成NH4+的離子方程式為。發布:2024/11/18 8:0:1組卷:9引用:1難度:0.5


