已知:①銅礦石中含有Cu2(OH)2CO3及含鐵元素的雜質
②黃銨鐵礬的化學式為(NH4)xFey(SO4)m(OH)n,其中鐵為+3價。
某興趣小組利用該銅礦石制黃銨鐵礬的流程如圖:
(1)Cu2(OH)2CO3與稀硫酸反應時離子方程式 Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑。
(2)黃銨鐵礬高溫下分解可得到一種紅棕色固體,該紅棕色固體的化學式為 Fe2O3Fe2O3。
(3)H2O2可以將Fe2+轉化成Fe3+.但溫度過高時,Fe2+轉化率下降,其原因 過氧化氫高溫下分解過氧化氫高溫下分解。
(4)該小組為測定黃銨鐵礬的組成,進行了如下實驗:
a.稱取mg樣品,加鹽酸完全溶解后,將所得溶液分為兩等份:
b.向一份中加入足量NaOH溶液并加熱,收集到標準狀況下112mL的氣體(發生反應:NH+4+OH- △ NH3↑十H2O,假設氣體全部逸出):將所得沉淀過濾、洗滌、灼燒至恒重,得到紅棕色粉末0.60g;
c.向另一份中加足量BaCl2溶液充分反應后,過濾、洗滌、干燥得沉淀2.33g。
①黃銨鐵礬中NH+4與SO2-4的個數比為 1:21:2;
②通過計算確定黃銨鐵礬的化學式 (NH4)2Fe3(SO4)4(OH)3(NH4)2Fe3(SO4)4(OH)3。(寫出必要的計算過程,否則不得分)
NH
+
4
△
NH
+
4
SO
2
-
4
【考點】探究物質的組成或測量物質的含量.
【答案】Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑;Fe2O3;過氧化氫高溫下分解;1:2;(NH4)2Fe3(SO4)4(OH)3
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:59引用:3難度:0.4
相似題
-
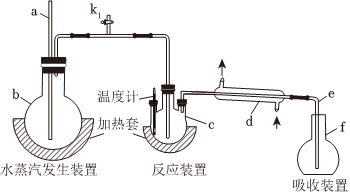 1.為測定某氟化稀土樣品中氟元素的質量分數進行如下實驗。利用高氯酸(高沸點酸)將樣品中的氟元素轉化為氟化氫(低沸點酸)蒸出,再通過滴定測量,實驗裝置如圖所示。(1)a的作用是 ,f儀器的名稱是(2)檢查裝置氣密性:首先(填操作),關閉k1,微熱c,f中有氣泡冒出;停止加熱,導管e內形成一段穩定的水柱,說明裝置氣密性良好。(3)c中加入一定體積高氯酸和mg氟化稀土樣品,f中盛有滴加酚酞的NaOH溶液。加熱b、c,使水蒸氣進入c。①下列物質可代替高氯酸的是(填序號)A.硝酸 B.鹽酸 C.硫酸 D.磷酸②實驗中除有HF氣體外,可能還有少量SiF4(易水解)氣體生成,若有SiF4生成,實驗結果將(填“偏高”“偏低”或”不受影響”)。③若觀察到f中溶液紅色褪去,需要向f中及時補加NaOH溶液,否則會使實驗結果偏低,原因是。(4)向餾出液中加入V1mL c1 mol/L La(NO3)3溶液,得到LaF3沉淀,再用c2mol/L EDTA標準溶液滴定剩余的La3+(La3+與EDTA按1:1絡合),消耗EDTA標準溶液V2 mL,則氟化稀土樣品中氟的質量分數為。(F的相對原子質量為19)(5)用樣品進行實驗前,需要用0.084g氟化鈉代替樣品進行實驗,改變條件(高氯酸用量、反應溫度、蒸餾實驗),測量并計算出氟元素質量,重復多次。該操作的目的是。發布:2025/1/18 8:0:1組卷:24引用:1難度:0.5
1.為測定某氟化稀土樣品中氟元素的質量分數進行如下實驗。利用高氯酸(高沸點酸)將樣品中的氟元素轉化為氟化氫(低沸點酸)蒸出,再通過滴定測量,實驗裝置如圖所示。(1)a的作用是 ,f儀器的名稱是(2)檢查裝置氣密性:首先(填操作),關閉k1,微熱c,f中有氣泡冒出;停止加熱,導管e內形成一段穩定的水柱,說明裝置氣密性良好。(3)c中加入一定體積高氯酸和mg氟化稀土樣品,f中盛有滴加酚酞的NaOH溶液。加熱b、c,使水蒸氣進入c。①下列物質可代替高氯酸的是(填序號)A.硝酸 B.鹽酸 C.硫酸 D.磷酸②實驗中除有HF氣體外,可能還有少量SiF4(易水解)氣體生成,若有SiF4生成,實驗結果將(填“偏高”“偏低”或”不受影響”)。③若觀察到f中溶液紅色褪去,需要向f中及時補加NaOH溶液,否則會使實驗結果偏低,原因是。(4)向餾出液中加入V1mL c1 mol/L La(NO3)3溶液,得到LaF3沉淀,再用c2mol/L EDTA標準溶液滴定剩余的La3+(La3+與EDTA按1:1絡合),消耗EDTA標準溶液V2 mL,則氟化稀土樣品中氟的質量分數為。(F的相對原子質量為19)(5)用樣品進行實驗前,需要用0.084g氟化鈉代替樣品進行實驗,改變條件(高氯酸用量、反應溫度、蒸餾實驗),測量并計算出氟元素質量,重復多次。該操作的目的是。發布:2025/1/18 8:0:1組卷:24引用:1難度:0.5 -
2.為探究礦石樣品X(僅含兩種元素)的組成和性質,某同學設計并完成如圖實驗:
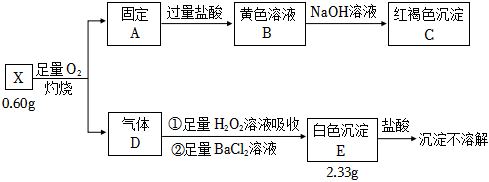
請回答:
(1)X含有的元素。
(2)X的化學式。
(3)紅褐色沉淀C是。
(4)氣體D通入足量H2O2中發生反應①的化學方程式。發布:2024/12/30 14:30:1組卷:15引用:3難度:0.7 -
3.煤氣化是有效利用化石能源手段之一,有關反應如下:
①C+H2OCO+H2 ②CO+H2O高溫CO2+H2一定條件
獲得的氣體稱為水煤氣。某研究性學習小組為探究氣體的成分進行了如下實驗:
[實驗]使水蒸氣通過灼熱的焦炭,收集反應后流出的氣體。
[提出假設]對氣體的成分提出了三種假設。
假設1:該氣體是 CO、H2。
假設2:該氣體是 CO、H2、H2O。
(1)假設3:。
[設計實驗方案,驗證假設]
他們擬用下圖中提供的儀器,選擇必要的試劑,設計一個實驗,驗證上述假設(加熱裝置和導管等在圖中略去,實驗前裝置內部的空氣已經排盡)。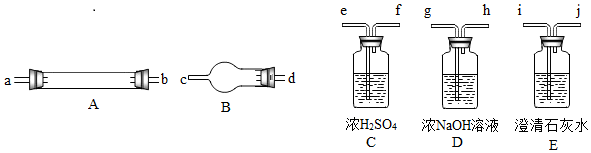
(2)按氣流從左至右連接各儀器,用題中小寫字母表示接口的連接順序(儀器可重復使用):
混合氣→dc→→→ij→→→→ij;
(3)儀器A中需加入試劑的是,其中反應的化學方程式是;
(4)儀器B中需加入試劑的名稱是,其作用是;
[思考與交流]
(5)本實驗的尾氣需要處理,處理的方法為。
(6)某同學認為增加焦炭的量可以提高化學反應①的速率,你是否同意他的說法,并簡述理由。發布:2024/12/30 14:0:1組卷:34引用:4難度:0.5


