汽車尾氣排放的一氧化碳、氮氧化物等氣體已成為大氣污染的主要來源。德國大眾汽車尾氣檢測造假事件引起全世界震驚。根據下列示意圖回答有關問題:
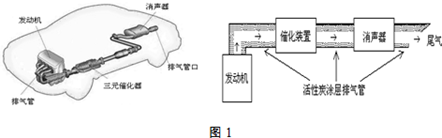
(1)汽車發動機工作時會引發N2(g)+O2(g)=2NO(g)△H=+180kJ?mol-1,其能量變化示意圖如下:
則NO中氮氧鍵的鍵能為632632kJ?mol-1;
(2)空燃比過小易產生CO.有人提出可以設計反應2CO(g)=2C(s)+O2(g)來消除CO的污染。判斷該設想是否可行,并說出理由不合理,該反應焓增、熵減,任何條件下都不能自發進行或該反應△H>0,△S<0 則△G>0不合理,該反應焓增、熵減,任何條件下都不能自發進行或該反應△H>0,△S<0 則△G>0;
(3)利用活性炭涂層排氣管處理NOx的反應為:xC(s)+2NOx(g)?N2(g)+xCO2 (g)△H=-b kJ?mol-1.若使NOx更加有效的轉化為無毒尾氣排放,以下措施理論上可行的是ADAD;
A.增加排氣管長度 B.增大尾氣排放口
C.升高排氣管溫度 D.添加合適的催化劑
(4)催化裝置中涉及的反應之一為:2NO(g)+2CO(g)?N2(g)+2CO2(g)。
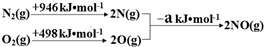
①探究上述反應中NO的平衡轉化率與壓強、溫度的關系,得到圖2所示的曲線。催化裝置比較適合的溫度和壓強是400K,1MPa400K,1MPa;
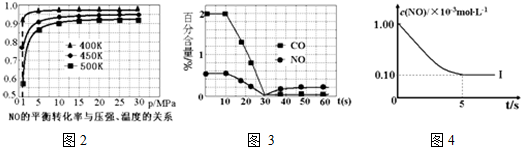
②測試某型號汽車在冷啟動(冷啟動指發動機水溫低的情況下啟動)時催化裝置內CO和NO百分含量隨時間變化曲線如圖3所示。則前10s 內,CO和NO百分含量沒明顯變化的原因是尚未達到催化劑工作溫度(或尚未達到反應的溫度)尚未達到催化劑工作溫度(或尚未達到反應的溫度);
③研究表明:在使用等質量催化劑時,增大催化劑比表面積可提高化學反應速率。為了分別驗證溫度、催化劑比表面積對化學反應速率的影響規律,某同學設計了以下三組實驗:
| 實驗編號 | T(K) | NO初始濃度 (mol?L-1) |
CO初始濃度 (mol?L-1) |
催化劑的比表面積(m2/g) |
| Ⅰ | 400 | 1.00×10-3 | 3.60×10-3 | 82 |
| Ⅱ | 400 | 1.00×10-3 | 3.60×10-3 | 124 |
| Ⅲ | 450 | 1.00×10-3 | 3.60×10-3 | 124 |
5000L?mol-1
5000L?mol-1
。【答案】632;不合理,該反應焓增、熵減,任何條件下都不能自發進行或該反應△H>0,△S<0 則△G>0;AD;400K,1MPa;尚未達到催化劑工作溫度(或尚未達到反應的溫度);5000L?mol-1
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:94引用:4難度:0.1
相似題
-
1.下列說法不正確的是( )
A.CH3COOH 溶液加水稀釋后,溶液中 的值減小c(CH3COOH)c(CH3COO-)B.已知一定溫度下,醋酸溶液的物質的量濃度為c,電離度為α,Ka= .若加入少量醋酸鈉固體,則CH3COOH?CH3COO-+H+向左移動,α減小,Ka變小(cα)2c(1-α)C.實驗測得環己烷(l)、環己烯(l)和苯(l)的標準燃燒熱分別為-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以證明在苯分子中不存在獨立的碳碳雙鍵 D.已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g),△H=+489.0 kJ/mol.
CO(g)+O2(g)═CO2(g),△H=-283.0 kJ/mol.12
C(石墨)+O2(g)═CO2(g),△H=-393.5 kJ/mol.
則4Fe(s)+3O2(g)═2Fe2O3(s),△H=-1641.0 kJ/mol發布:2025/1/1 8:0:2組卷:11引用:1難度:0.7 -
2.下列與化學反應的能量變化有關的敘述正確的是( )
A.由石墨比金剛石穩定可知,C(金剛石)═C(石墨)△H<0 B.一個反應的反應物的總能量可能等于其生成物的總能量 C.有熱量變化的反應一定是化學反應 D.強酸與強堿的中和反應的熱化學方程式均可表示為H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ?mol-1 發布:2025/1/6 6:0:5組卷:1引用:3難度:0.6 -
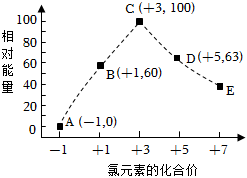 3.一定條件下,在水溶液中物質的量均為1mol的Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相對大小如圖所示。圖中最穩定的點為( )
3.一定條件下,在水溶液中物質的量均為1mol的Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相對大小如圖所示。圖中最穩定的點為( )A.A B.B C.C D.D 發布:2025/1/6 6:0:5組卷:0引用:1難度:0.9


