2015-2016學年河北省衡水市武邑中學高二(下)化學暑假作業(33)
發布:2024/4/20 14:35:0
一、選擇題(共12小題,每小題3分,滿分36分)
-
1.中國絲綢有五千年的歷史和文化.古代染坊常用某種“堿劑”來精煉絲綢,該“堿劑”的主要成分是一種鹽,能促進蠶絲表層的絲膠蛋白雜質水解而除去,使絲綢顏色潔白、質感柔軟、色澤光亮.這種“堿劑”可能是( )
A.食鹽 B.火堿 C.草木灰 D.膽礬 組卷:287引用:29難度:0.9 -
2.下面的原子或原子團不屬于官能團的是( )
A.NO3- B.-Cl C.-OH D. 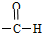 組卷:58引用:4難度:0.9
組卷:58引用:4難度:0.9 -
3.下列化學用語正確的是( )
A.甲醛的結構式 CH4 B.溴乙烷的分子式 CH3CH2Br C.乙烯的結構簡式 CH2CH2 D.苯的最簡式 CH 組卷:0引用:1難度:0.6 -
4.實驗室有下列試劑,其中必須用帶橡膠塞的試劑瓶保存的是( )
①NaOH溶液 ②水玻璃 ③Na2S溶液 ④Na2CO3溶液 ⑤NH4Cl溶液 ⑥澄清石灰水 ⑦濃HNO3⑧濃H2SO4.A.①⑥ B.①②③④⑥ C.①②③⑥⑦⑧ D.⑤⑦⑧ 組卷:67引用:15難度:0.9 -
5.將純鋅片和純銅片按圖示方式插入同濃度的稀硫酸中一段時間,下列敘述正確的是( )
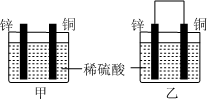
A.裝置甲中銅片表面產生氣泡 B.裝置甲溶液中 -向銅片做定向移動SO24C.裝置乙中電子從銅片經導線流向鋅片 D.裝置乙中正極的電極反應式:2H++2e-═H2↑ 組卷:579引用:16難度:0.9 -
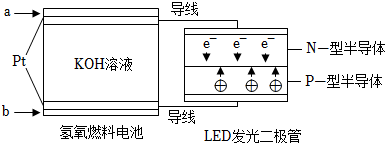 6.LED產品的使用為城市增添色彩.圖是氫氧燃料電池驅動LED發光的一種裝置示意圖.下列有關敘述正確的是( )
6.LED產品的使用為城市增添色彩.圖是氫氧燃料電池驅動LED發光的一種裝置示意圖.下列有關敘述正確的是( )A.P-型半導體連接的是電池負極 B.b處為電池正極,發生了還原反應 C.a處通入氫氣,發生還原反應 D.該裝置中只涉及兩種形式的能量轉化 組卷:11引用:2難度:0.9
二、非選擇題:
-
18.直接排放含SO2的煙氣會形成酸雨,危害環境。利用鈉堿循環法可脫除煙氣中的SO2。
(1)用化學方程式表示SO2形成硫酸型酸雨的反應:;
(2)在鈉堿循環法中,Na2SO3溶液作為吸收液,可由NaOH溶液吸收SO2制得,該反應的離子方程式是;
(3)吸收液吸收SO2的過程中,pH隨n(SO32-):n(HSO3-)變化關系如下表:
①上表判斷NaHSO3溶液顯n(SO32-):n(HSO3-) 91:9 1:1 9:91 pH 8.2 7.2 6.2 性,用化學平衡原理解釋;
②當吸收液呈中性時,溶液中離子濃度關系正確的是(選填字母):;
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(4)當吸收液的pH降至約為6時,需送至電解槽再生。再生示意圖如下: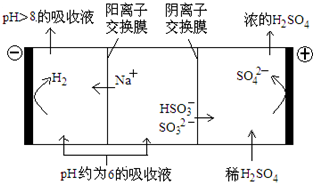
①HSO3-在陽極放電的電極反應式是;
②當陰極室中溶液pH升至8以上時,吸收液再生并循環利用。簡述再生原理。組卷:177引用:3難度:0.5 -
19.汽車尾氣排放的一氧化碳、氮氧化物等氣體已成為大氣污染的主要來源。德國大眾汽車尾氣檢測造假事件引起全世界震驚。根據下列示意圖回答有關問題:
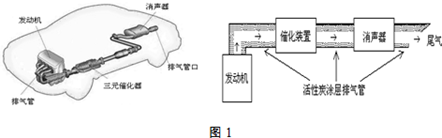
(1)汽車發動機工作時會引發N2(g)+O2(g)=2NO(g)△H=+180kJ?mol-1,其能量變化示意圖如下: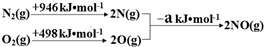
則NO中氮氧鍵的鍵能為kJ?mol-1;
(2)空燃比過小易產生CO.有人提出可以設計反應2CO(g)=2C(s)+O2(g)來消除CO的污染。判斷該設想是否可行,并說出理由;
(3)利用活性炭涂層排氣管處理NOx的反應為:xC(s)+2NOx(g)?N2(g)+xCO2 (g)△H=-b kJ?mol-1.若使NOx更加有效的轉化為無毒尾氣排放,以下措施理論上可行的是;
A.增加排氣管長度 B.增大尾氣排放口
C.升高排氣管溫度 D.添加合適的催化劑
(4)催化裝置中涉及的反應之一為:2NO(g)+2CO(g)?N2(g)+2CO2(g)。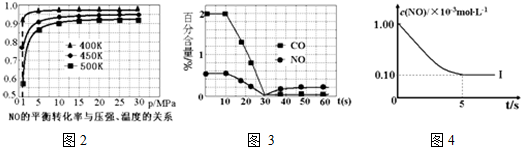
①探究上述反應中NO的平衡轉化率與壓強、溫度的關系,得到圖2所示的曲線。催化裝置比較適合的溫度和壓強是;
②測試某型號汽車在冷啟動(冷啟動指發動機水溫低的情況下啟動)時催化裝置內CO和NO百分含量隨時間變化曲線如圖3所示。則前10s 內,CO和NO百分含量沒明顯變化的原因是;
③研究表明:在使用等質量催化劑時,增大催化劑比表面積可提高化學反應速率。為了分別驗證溫度、催化劑比表面積對化學反應速率的影響規律,某同學設計了以下三組實驗:
根據坐標圖4,計算400K時該反應的平衡常數為實驗編號 T(K) NO初始濃度
(mol?L-1)CO初始濃度
(mol?L-1)催化劑的比表面積(m2/g) Ⅰ 400 1.00×10-3 3.60×10-3 82 Ⅱ 400 1.00×10-3 3.60×10-3 124 Ⅲ 450 1.00×10-3 3.60×10-3 124 。組卷:94引用:4難度:0.1


