試劑級NaCl可用海鹽(含泥沙、海藻、K+、Ca2+、Mg2+、Fe3+、SO42-等雜質)為原料制備。制備流程簡圖如下:海鹽→焙炒→溶解→除雜→濾液→操作X→飽和溶液通HCl結晶→NaCl
(1)焙炒海鹽的目的是除去海藻等有機雜質,并使其顆粒變小除去海藻等有機雜質,并使其顆粒變小。
(2)操作X為蒸發濃縮蒸發濃縮。
(3)用如圖所示裝置,以焙炒后的海鹽為原料制備HCl氣體,并通入NaCl飽和溶液中使氯化鈉晶體析出。

①試劑a為濃硫酸濃硫酸。
②從平衡理論解釋向飽和食鹽水中通HCl氣體析出晶體的原因NaCl(s)?Na++Cl-,HCl溶于水,使溶液中Cl-增多,平衡逆移,析出氯化鈉晶體NaCl(s)?Na++Cl-,HCl溶于水,使溶液中Cl-增多,平衡逆移,析出氯化鈉晶體。(用化學用語和文字回答)
(4)已知CrO42-+Ba2+═BaCrO4↓(黃色)設計如下實驗測定NaCl產品中SO42-的含量,填下列表格。
通
HC
l
| 操作 | 現象 | 目的/結論 | |
| ① | 稱取樣品m1g,加水溶解,加鹽酸調至弱酸性,滴加過量c1mol?L-1BaCl2溶液V1mL | 稍顯渾濁 | 目的: 使SO42-完全沉淀 使SO42-完全沉淀 。 |
| ② | 繼續滴加過量c2mol?L-1K2CrO4溶液V2mL | 產生黃色沉淀 | 目的:沉淀過量的Ba2+。 |
| ③ | 過量洗滌,滴加少許指示劑 六氰合鐵酸鉀 六氰合鐵酸鉀 (填寫試劑名稱)溶液于濾液中,用c3mol?L-1FeSO4溶液滴定至終點,消耗FeSO4溶液V3mL |
滴定終點的現象是 有藍色沉淀生成 有藍色沉淀生成 。 |
FeSO4溶液和K2CrO4溶液反應的離子方程式 CrO42-+3Fe2++8H+=Cr3++4H2O+3Fe3+ CrO42-+3Fe2++8H+=Cr3++4H2O+3Fe3+ ,結論:SO42-的質量分數為9 . 6 ( c 1 V 1 - c 2 V + 1 3 c 3 V 3 ) m 1 % 9 . 6 ( c 1 V 1 - c 2 V + 1 3 c 3 V 3 ) m 1 % |
【考點】粗鹽提純.
【答案】除去海藻等有機雜質,并使其顆粒變小;蒸發濃縮;濃硫酸;NaCl(s)?Na++Cl-,HCl溶于水,使溶液中Cl-增多,平衡逆移,析出氯化鈉晶體;使SO42-完全沉淀;六氰合鐵酸鉀;有藍色沉淀生成;CrO42-+3Fe2++8H+=Cr3++4H2O+3Fe3+;
9
.
6
(
c
1
V
1
-
c
2
V
+
1
3
c
3
V
3
)
m
1
%
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:56引用:1難度:0.5
相似題
-
1.為了除去KCl溶液中少量的MgCl2、MgSO4雜質,可選用Ba(OH)2溶液、稀鹽酸和K2CO3溶液三種試劑,按圖步驟操作:
溶液加過量A濾液加過量B操作Ⅰ加過量C較純凈的KCl溶液加熱煮沸
(1)寫出下列試劑的化學式:A,C
(2)根據題意,回答下列問題:
①加入過量A的目的是,
②加入過量B的目的是,
③加熱煮沸的目的是,
(3)操作Ⅰ的名稱是。發布:2024/12/14 8:0:2組卷:53引用:1難度:0.6 -
2.除去粗鹽中的雜質 CaCl2、MgCl2和 Na2SO4,過程如下:

下列有關說法中,不正確的是( )A.除去 Mg2+的主要反應:MgCl2+2NaOH-=Mg(OH)2↓+2NaCl B.試劑①一定不是Na2CO3溶液 C.檢驗 是否除凈:取少量濾液,加稀鹽酸酸化,再加 BaCl2溶液SO2-4D.濾液加稀鹽酸時只發生反應:HCl+NaOH=H2O+NaCl 發布:2024/12/30 4:0:1組卷:123引用:11難度:0.8 -
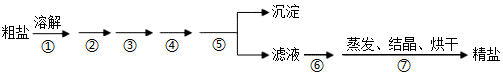
3.通過海水晾曬可得粗鹽,粗鹽除NaCl外,還含有MgCl2、CaCl2、Na2SO4以及泥沙等雜質,粗鹽精制的實驗流程如下。下列說法不正確的是( )
A.在第①步中使用玻璃棒攪拌可加速粗鹽溶解 B.第⑤步操作是過濾 C.在第②③④⑥步通過加入化學試劑除雜,加入試劑順序為:NaOH溶液→Na2CO3溶液→BaCl2溶液→稀鹽酸 D.除去MgCl2的離子方程式為:Mg2++2OH-=Mg(OH)2↓ 發布:2024/12/30 4:30:1組卷:91引用:5難度:0.8


