2021年天津市十二區(qū)縣重點學(xué)校高考化學(xué)聯(lián)考試卷(二)
發(fā)布:2024/4/20 14:35:0
一、選擇題
-
1.五年來,我國在探索太空,開發(fā)深海,建設(shè)世界一流的高鐵、橋梁、碼頭,5G技術(shù)聯(lián)通世界等領(lǐng)域取得了舉世矚目的成就。這些項目與化學(xué)有著密切聯(lián)系。下列說法正確的是( )
A.實現(xiàn)海上首飛的“鯤龍”水陸兩棲飛機(jī)的燃料--航空煤油屬于一種烴類化合物 B.為打造生態(tài)文明建設(shè),我國近年大力發(fā)展核電、光電、風(fēng)電、水電,電能屬于二次能源 C.我國提出網(wǎng)絡(luò)強(qiáng)國戰(zhàn)略,光纜線路總長超過三千萬公里,光纜的主要成分是晶體硅 D.“神舟十一號”宇宙飛船返回艙外表面使用的高溫結(jié)構(gòu)陶瓷的主要成分是硅酸鹽 組卷:26引用:1難度:0.7 -
2.NA代表阿伏加德羅常數(shù)的值。下列說法正確的是( )
A.向含1mol?L-1Cl-的NH4Cl溶液中加入氨水使溶液呈中性,溶液中NH4+的數(shù)目為NA B.用濃鹽酸分別和MnO2、KClO3反應(yīng)制備22.4L(標(biāo)準(zhǔn)狀況下)Cl2,轉(zhuǎn)移的電子數(shù)均為2NA C.10g 46%甲酸(HCOOH)水溶液所含的氧原子數(shù)為0.5NA D.60g SiO2和28g Si中各含有4NA個Si-O鍵和4NA個Si-Si鍵 組卷:50引用:1難度:0.6 -
3.下列反應(yīng)的方程式不正確的是( )
A.硫酸銅溶液中加足量氨水:Cu2++4NH3?H2O═Cu(NH3)42++4H2O B.用銅作電極電解NaCl溶液:2Cl-+2H2O H2↑+Cl2↑+2OH-通電C.SO2氣體通入足量NaClO溶液中:SO2+H2O+3ClO-═Cl-+SO42-+2HClO D.等物質(zhì)的量的Ba(OH)2與NH4HSO4在溶液中反應(yīng):Ba2++2OH-+NH4+H++SO42-═BaSO4↓+H2O+NH3?H2O 組卷:82引用:2難度:0.5 -
4.常溫下,下列各組離子在指定溶液中能大量共存的是( )
A.堿性溶液中:ClO-、S2-、SO32-、Na+ B.含有大量NO3-的水溶液中:NH4+、HPO42-、SO42-、PO43- C.pH=0的溶液中:Na+、Cl-、MnO4-、SO42- D.中性溶液:Fe3+、NH4+、AlO2-、CH3COO- 組卷:69引用:4難度:0.8 -
5.短周期主族元素A、B、C、D、E的原子序數(shù)依次增大。A原子的最外層電子數(shù)是內(nèi)層電子數(shù)的2倍;B、D同主族且質(zhì)子數(shù)之比為1:2;元素C是地殼中含量最豐富的金屬元素。下列說法不正確的是( )
A.簡單離子半徑:D>E>B>C B.元素B與元素C形成的化合物可作耐火材料 C.氫化物的沸點:B>A D.元素A與元素D的單質(zhì)均存在多種同素異形體 組卷:59引用:3難度:0.5
二、非選擇題
-
15.試劑級NaCl可用海鹽(含泥沙、海藻、K+、Ca2+、Mg2+、Fe3+、SO42-等雜質(zhì))為原料制備。制備流程簡圖如下:海鹽→焙炒→溶解→除雜→濾液→操作X→飽和溶液
結(jié)晶→NaCl通HCl
(1)焙炒海鹽的目的是。
(2)操作X為。
(3)用如圖所示裝置,以焙炒后的海鹽為原料制備HCl氣體,并通入NaCl飽和溶液中使氯化鈉晶體析出。
①試劑a為。
②從平衡理論解釋向飽和食鹽水中通HCl氣體析出晶體的原因。(用化學(xué)用語和文字回答)
(4)已知CrO42-+Ba2+═BaCrO4↓(黃色)設(shè)計如下實驗測定NaCl產(chǎn)品中SO42-的含量,填下列表格。操作 現(xiàn)象 目的/結(jié)論 ① 稱取樣品m1g,加水溶解,加鹽酸調(diào)至弱酸性,滴加過量c1mol?L-1BaCl2溶液V1mL 稍顯渾濁 目的: 。② 繼續(xù)滴加過量c2mol?L-1K2CrO4溶液V2mL 產(chǎn)生黃色沉淀 目的:沉淀過量的Ba2+。 ③ 過量洗滌,滴加少許指示劑 (填寫試劑名稱)溶液于濾液中,用c3mol?L-1FeSO4溶液滴定至終點,消耗FeSO4溶液V3mL滴定終點的現(xiàn)象是 。FeSO4溶液和K2CrO4溶液反應(yīng)的離子方程式 ,結(jié)論:SO42-的質(zhì)量分?jǐn)?shù)為。(列算式)組卷:56引用:1難度:0.5 -
16.乙烯是重要的化工原料,科研工作者正在探索和研發(fā)制備乙烯的新方法。
Ⅰ.甲烷在一定條件下脫氫可生成乙烯:2CH4(g)C2H4(g)+H2(g)△H>0催化劑
(1)活化能Ea正Ea逆(填“>”、“=”或“<”,下同);k正、k逆表示速率常數(shù),當(dāng)升高溫度時,k正增大的倍數(shù)k逆增大的倍數(shù)。
Ⅱ.利用生物無水乙醇催化脫水制備乙烯
主反應(yīng)ⅰ:C2H5OH(g)C2H4(g)+H2O(g)△H1=+45.5kJ/mol催化劑
副反應(yīng)ⅱ:2C2H5OH(g)C2H5OC2H5(g)+H2O(g)△H2=-19.0kJ/mol催化劑
副反應(yīng)ⅲ:C2H5OC2H5(g)2C2H4(g)+H2O(g)△H3催化劑
(2)△H3=。
(3)在2L恒容密閉容器中充入2mol C2H5OH(g)和一定量的催化劑進(jìn)行反應(yīng),平衡體系中含碳組分的物質(zhì)的量(乙醇、X、Y物質(zhì)的量分?jǐn)?shù)之和為1)隨溫度的變化如圖1所示。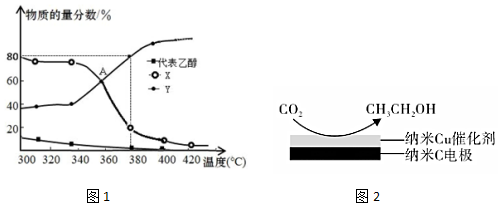
①圖中Y代表(填“C2H4”或“C2H5OC2H5”),請解釋原因。
②主反應(yīng)ⅰ在A點達(dá)到平衡狀態(tài)標(biāo)志為。(填序號)
a.乙烯濃度不再變化
b.容器內(nèi)壓強(qiáng)不隨時間變化
c.混合氣體的密度不隨時間變化
d.△H不再變化
③380℃設(shè)乙醇完全反應(yīng),則反應(yīng)ⅲ的平衡常數(shù)K=。
(4)用CO2制備乙醇:在經(jīng)CO2飽和處理的KHCO3電解液中(CO2足量),電解活化CO2制備乙醇的原理如圖2所示。
①陰極的電極反應(yīng)式為。
②從電解質(zhì)溶液中分離出乙醇的操作方法是。組卷:30引用:1難度:0.5


