 Ⅰ.①碳酸氫鈉②醋酸鈉③碳酸鈉④硫酸鋁。將上述①③④的水溶液加熱并蒸干,其中能得到相應的鹽的是③④③④(填序號);①的水溶液顯堿性,因此大于大于水解電離 (寫“大于”、“小于”、“等于”),②中離子濃度由大到小排列c(Na+)>c(CH3COO-)>c(OH-)>c(H+)c(Na+)>c(CH3COO-)>c(OH-)>c(H+)。
Ⅰ.①碳酸氫鈉②醋酸鈉③碳酸鈉④硫酸鋁。將上述①③④的水溶液加熱并蒸干,其中能得到相應的鹽的是③④③④(填序號);①的水溶液顯堿性,因此大于大于水解電離 (寫“大于”、“小于”、“等于”),②中離子濃度由大到小排列c(Na+)>c(CH3COO-)>c(OH-)>c(H+)c(Na+)>c(CH3COO-)>c(OH-)>c(H+)。
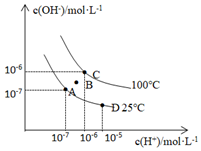
Ⅱ.已知水的電離平衡曲線如圖所示:
(1)圖中C點水的離子積常數為1×10-121×10-12。
(2)從A點到D點,可采取的措施是bb。
a.升溫
b.加入少量鹽酸
c.降溫
d.加入少量NaOH
(3)100℃時,pH=2的鹽酸中水電離產生的H+濃度為10-10mol/L10-10mol/L。
(4)25℃時,將pH=12的NaOH溶液與pH=3的H2SO4溶液混合,若所得混合溶液pH=7,則NaOH溶液與H2SO4溶液的體積比為1:101:10。
(5)能證明醋酸是弱酸的是acdacd。
a.醋酸鈉溶液顯堿性
b.醋酸能與水互溶
c.0.1mol?L-1醋酸溶液的pH=3
d.鹽酸可與醋酸鈉反應
【考點】弱電解質的電離平衡.
【答案】③④;大于;c(Na+)>c(CH3COO-)>c(OH-)>c(H+);1×10-12;b;10-10mol/L;1:10;acd
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:44引用:2難度:0.7
相似題
-
1.用水稀釋0.1mol/L的醋酸溶液,其中隨加水量的增加而增大的有( )
A.C(CH3COOH) B.C(H+) C.C(H+)/C(CH3COOH) D.C(CH3COOH)/C(H+) 發布:2025/1/1 8:0:2組卷:3引用:1難度:0.9 -
2.25℃時,用蒸餾水稀釋0.10mol?L-1的醋酸,若用KW表示水的離子積常數,則下列各式表 示的數值隨水量的增加而增大的是( )
A. [CH3COOH][H+]B. [CH3COO-][CH3COOH]C. [H+]kWD. [H+][OH-]發布:2025/1/1 8:0:2組卷:1引用:1難度:0.7 -
3.將0.1mol?L-1的醋酸溶液加水稀釋,則( )
A.中和此溶液所需的0.1 mol?L-1 NaOH溶液的體積增加 B.c(CH3COOH)減小,平衡向電離方向移動,c(CH3COO-)增大 C.平衡向電離方向移動,c(CH3COOH)、c(H+)、c(OH-)、c(CH3COO-)均減小 D.電離程度增大,由CH3COOH電離出的n(H+)變大 發布:2025/1/1 8:0:2組卷:6引用:1難度:0.7


