魯科版(2019)選擇性必修1《3.1 水與水溶液》2021年同步練習(xí)卷(6)
發(fā)布:2024/4/20 14:35:0
一、單選題
-
1.常溫下,濃度均為0.1mol/L的下列四種鹽溶液,其pH測(cè)定如表所示:
下列說(shuō)法正確的是( )序號(hào) ① ② ③ ④ 溶液 CH3COONa NaHCO3 Na2CO3 NaClO pH 8.8 9.7 11.6 10.3 A.四種溶液中,水的電離程度①>②>④>③ B.Na2CO3和NaHCO3溶液中,粒子種類(lèi)相同 C.將等濃度的CH3COOH和HClO溶液,pH小的是HClO D.Na2CO3溶液中,c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) 組卷:79引用:6難度:0.9 -
2.下列事實(shí)能說(shuō)明醋酸是弱電解質(zhì)的是( )
①醋酸與水能以任意比互溶;
②醋酸溶液能導(dǎo)電;
③醋酸溶液中存在醋酸分子;
④常溫下,0.1mol/L醋酸的pH比0.1mol/L鹽酸的pH大;
⑤醋酸能和碳酸鈣反應(yīng)放出CO2;
⑥pH=3的醋酸溶液加水稀釋至原溶液體積的10倍后,pH<4;
⑦大小相同的鐵片與同物質(zhì)的量濃度的鹽酸和醋酸反應(yīng),醋酸產(chǎn)生H2速率慢。A.②⑥⑦ B.①② C.③④⑤⑥ D.③④⑥⑦ 組卷:64引用:3難度:0.5 -
3.如圖表示水中c(H+)和c(OH-)的關(guān)系.下列判斷正確的是( )
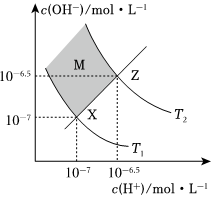
A.圖中T1>T2 B.XZ線上任意點(diǎn)均有pH<7 C.兩條曲線間任意點(diǎn)均有c(H+)×c(OH+)═KW=1×10-13 D.M區(qū)域內(nèi)任意點(diǎn)對(duì)應(yīng)的溶液中下列離子均可大量共存:S2-、 、Na+、Cl-SO2-4組卷:115引用:5難度:0.7 -
4.將pH為5的硫酸溶液稀釋500倍,稀釋后溶液中c(H+):c(SO42-)約為( )
A.10:1 B.1:10 C.2:1 D.1:1 組卷:14引用:3難度:0.7 -
5.電解質(zhì)溶液有許多奇妙之處,下列關(guān)于電解質(zhì)溶液的敘述中正確的是( )
A.Na2CO3、NaHCO3兩種鹽溶液中,離子種類(lèi)不相同 B.物質(zhì)的量濃度相同的NH4Cl和NH4HSO4兩種溶液中,c(NH4+)前者小于后者 C.常溫下,某溶液中由水電離出的c(H+)=10-5mol?L-1,則此溶液可能是鹽酸 D.常溫下,1 mol?L-1的CH3COOH溶液與1 mol?L-1的NaOH溶液等體積混合后,所得混合液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) 組卷:39引用:5難度:0.7 -
6.在25℃時(shí),將0.1mol?L-1的HA溶液與0.1mol?L-1的NaOH溶液等體積混合后,測(cè)得混合溶液pH=8,則下列所表示的該混合溶液中有關(guān)微粒的濃度關(guān)系中,錯(cuò)誤的是( )
A.c(HA)+c(A-)=c(Na+)=0.1mol?L-1 B.c(Na+)-c(A-)=c(OH-)-c(H+) C.c(Na+)>c(A-)>c(OH-)>c(H+) D.c(OH-)=c(H+)+c(HA) 組卷:19引用:8難度:0.7
二、綜合題
-
17.已知如表數(shù)據(jù)(25℃):
(1)25℃時(shí),將等體積等濃度的醋酸和氨水混合,混合溶液的pH物質(zhì) CH3COOH NH3?H2O HCN H2CO3 電離常數(shù)(K) 1.7×10-5 1.7×10-5 4.9×10-10 K1=4.3×10-7
K2=5.6×10-117(填“>”、“=”或“<”);該混合溶液中水的電離會(huì)受到。(填“促進(jìn)”、“抑制”、“既不促進(jìn)也不抑制”)
(2)NaCN溶液呈性,用離子方程式解釋原因。
(3)寫(xiě)出泡沫滅火器原理。(離子方程式)
(4)現(xiàn)有濃度為0.02mol/L的HCN溶液與0.01mol/L?NaOH溶液等體積混合之后(忽略混合過(guò)程中溶液體積的改變),測(cè)得c(Na+)>c(CN-),下列關(guān)系正確的是。
A.c(H+)>c(OH-)
B.c(HCN)>c(CN-)
C.c(H+)+c(HCN)=c(OH-)+c(CN-)
D.c(HCN)+c(CN-)=0.01mol/L組卷:32引用:2難度:0.5 -
 18.Ⅰ.①碳酸氫鈉②醋酸鈉③碳酸鈉④硫酸鋁。將上述①③④的水溶液加熱并蒸干,其中能得到相應(yīng)的鹽的是(填序號(hào));①的水溶液顯堿性,因此水解電離 (寫(xiě)“大于”、“小于”、“等于”),②中離子濃度由大到小排列。
18.Ⅰ.①碳酸氫鈉②醋酸鈉③碳酸鈉④硫酸鋁。將上述①③④的水溶液加熱并蒸干,其中能得到相應(yīng)的鹽的是(填序號(hào));①的水溶液顯堿性,因此水解電離 (寫(xiě)“大于”、“小于”、“等于”),②中離子濃度由大到小排列。
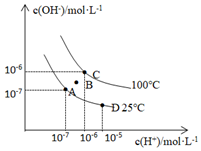
Ⅱ.已知水的電離平衡曲線如圖所示:
(1)圖中C點(diǎn)水的離子積常數(shù)為。
(2)從A點(diǎn)到D點(diǎn),可采取的措施是。
a.升溫
b.加入少量鹽酸
c.降溫
d.加入少量NaOH
(3)100℃時(shí),pH=2的鹽酸中水電離產(chǎn)生的H+濃度為。
(4)25℃時(shí),將pH=12的NaOH溶液與pH=3的H2SO4溶液混合,若所得混合溶液pH=7,則NaOH溶液與H2SO4溶液的體積比為。
(5)能證明醋酸是弱酸的是。
a.醋酸鈉溶液顯堿性
b.醋酸能與水互溶
c.0.1mol?L-1醋酸溶液的pH=3
d.鹽酸可與醋酸鈉反應(yīng)組卷:44引用:2難度:0.7


