當今,世界多國相繼規劃了碳達峰、碳中和的時間節點,我國力爭于2030年前做到碳達峰,2060年前實現碳中和。因此,研發二氧化碳利用技術,降低空氣中二氧化碳的含量成為研究熱點。
(1)大氣中的二氧化碳主要來自于煤、石油及其他含碳化合物的燃燒。已知25℃時,相關物質的燃燒熱數據如下表:
| 物質 | H2(g) | C(石墨,s) | C6H6(l) |
| 燃燒熱ΔH/(kJ?mol-1) | -285.8 | -393.5 | -3267.5 |
6C(石墨,s)+3H2(g)=C6H6(l)△H=+49.1kJmol-1
6C(石墨,s)+3H2(g)=C6H6(l)△H=+49.1kJmol-1
。(2)CH4與CO2重整是CO2利用的研究方向之一。該重整反應體系主要涉及以下反應:
a.CH4(g)+CO2(g)?2CO(g)+2H2(g)ΔH1
b.H2(g)+CO2(g)?CO(g)+H2O(g)ΔH2
c.CH4(g)?C(s)+2H2(g)ΔH3
d.2CO(g)?C(s)+CO2(g)ΔH4
e.H2(g)+CO(g)?C(s)+H2O(g)ΔH5
①上述反應體系在一定條件下建立平衡后,下列說法正確的有
AD
AD
。(填字母)A.增大CO2與CH4的濃度,反應a、b、c的正反應速率都增加
B.移去部分C(s),反應c、d、e的平衡均向右移動
C.加入反應a的催化劑,可提高CH4的平衡轉化率
D.降低反應溫度,反應a~e的正、逆反應速率都減小
②一定條件下,CH4分解形成碳的反應歷程如圖所示。該歷程經歷了
4
4
步反應,其中第 4
4
步的正反應速率最慢。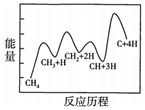
(3)以CO2、H2為原料合成CH3OH的主要反應如下:
Ⅰ.3H2(g)+CO2(g)?CH3OH(g)+H2O(g)ΔH1=-49.5kJ?mol-1
Ⅱ.2H2(g)+CO(g)?CH3OH(g)ΔH2=-90.4kJ?mol-1
Ⅲ.H2(g)+CO2(g)?CO(g)+H2O(g)ΔH3=+40.9kJ?mol-1
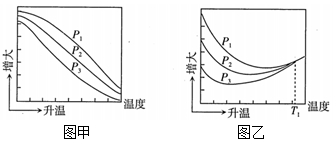
不同壓強下,按照n(CO2):n(H2)=1:3投料,實驗測得CO2的平衡轉化率和CH3OH的平衡產率隨溫度的變化關系如圖所示。
已知:CO2的平衡轉化率=
n
(
C
O
2
)
初始
-
n
(
C
O
2
)
平衡
n
(
C
O
2
)
初始
CH3OH的平衡產率=
n
(
C
H
3
OH
)
平衡
n
(
C
O
2
)
初始
其中縱坐標表示CO2平衡轉化率的是圖
乙
乙
(填“甲”或“乙”);壓強P1、P2、P3由大到小的順序為 p1>p2>p3
p1>p2>p3
;圖乙中T1溫度時,三條曲線幾乎交于一點的原因是 T1時以反應Ⅲ為主,反應Ⅲ前后氣體分子數相等,壓強改變對平衡沒有影響
T1時以反應Ⅲ為主,反應Ⅲ前后氣體分子數相等,壓強改變對平衡沒有影響
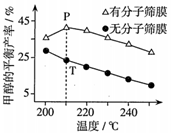
。(4)恒壓下,按照n(CO2):n(H2)=1:3投料發生反應Ⅰ,該反應在無分子篩膜時甲醇的平衡產率和有分子篩膜時甲醇的平衡產率隨溫度的變化如圖所示(分子篩膜具有選擇透過性)。P點甲醇的平衡產率高于T點的原因可能是
分子篩膜從反應體系中不斷分離出H2O,有利于反應正向進行,甲醇產率升高
分子篩膜從反應體系中不斷分離出H2O,有利于反應正向進行,甲醇產率升高
。
【答案】6C(石墨,s)+3H2(g)=C6H6(l)△H=+49.1kJmol-1;AD;4;4;乙;p1>p2>p3;T1時以反應Ⅲ為主,反應Ⅲ前后氣體分子數相等,壓強改變對平衡沒有影響;分子篩膜從反應體系中不斷分離出H2O,有利于反應正向進行,甲醇產率升高
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:13引用:1難度:0.6
相似題
-
1.氫在地球上主要以化合態的形式存在,是宇宙中分布最廣泛的物質,它構成了宇宙質量的75%,屬于二次能源.工業上生產氫的方式很多,常見的有水電解制氫,煤炭氣化制氫,重油及天然氣水蒸氣催化制氫等.氫氣是一種理想的綠色能源,如圖1為氫能產生和利用的途徑:
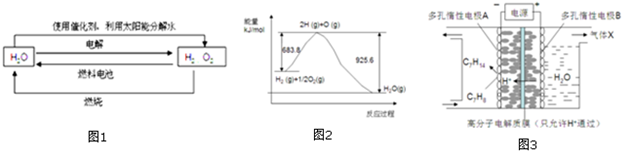
(1)圖1的四個過程中能量轉化形式有
A.2種 B.3種 C.4種 D.4種以上
(2)電解過程要消耗大量的電能,而使用微生物作催化劑在陽光下也能分解水.
2H2O(1)2H2(g)+O2(g)△H 1 2H2O(1)通電2H2(g)+O2(g)△H2光照催化劑
以上反應的△H1△H2(選填“<”、“>”或“=”)
(3)已知H2O(l)→H2O(g)△H=+44kJ.mol-1,依據圖2能量變化寫出氫氣燃燒生產液態水的熱化學方程式
(4)氫能利用需要選擇合適的儲氫材料.
①NaBH4是一種重要的儲氫載體,能與水反應生成NaBO2,且反應前后B的化合價不變,該反應的化學方程式為
②鑭鎳合金在一定條件下可吸收氫氣生產氫化物:LaNi3(s)+3H2(g)═LaNi3H6(s)△H<0,欲使LaNi3H6(s)釋放出氣態氫,根據平衡移動的原理,可改變的條件之一是
③一定條件下,如圖3所示裝置可實現有機物的電化學儲氫,使C7H8轉化為C7H14,則電解過程中產生的氣體X 為,電極A上發生的電極反應式為.發布:2024/12/17 8:0:2組卷:38引用:1難度:0.5 -
2.肼(N2H4)可作為發射火箭的燃料。已知1g液態肼(N2H4)氣體在空氣中燃燒生成氮氣和水蒸氣,放出16.7kJ的熱量,該反應的熱化學方程式是( )
A.N2H4(l)+O2(g)═2H2O(g)+N2(g),△H=-16.7kJ?mol-1 B.N2H4(l)+O2(g)═2H2O(l)+N2(g),△H=-534.4kJ?mol-1 C.N2H4(l)+O2(g)═2H2O(g)+N2(g),△H=-534.4kJ?mol-1 D.N2H4(l)+O2(g)═2H2O(g)+N2(g),△H=+534.4kJ?mol-1 發布:2024/12/30 3:0:4組卷:121引用:9難度:0.6 -
3.在298K、1.01×105Pa下,將0.5mol CO2通入750mL 1mol?L-1NaOH溶液中充分反應,測得反應放出xkJ的熱量。已知在該條件下,1mol CO2通入1L 2mol?L-1NaOH溶液中充分反應放出ykJ的熱量,則CO2與NaOH溶液反應生成NaHCO3的熱化學方程式正確的是( )
A.CO2(g)+NaOH(aq)═NaHCO3(aq)ΔH=-(2y-x)kJ?mol-1 B.CO2(g)+NaOH(aq)═NaHCO3(aq)ΔH=-(2x-y)kJ?mol-1 C.CO2(g)+NaOH(aq)═NaHCO3(aq)ΔH=-(4x-y)kJ?mol-1 D.2CO2(g)+2NaOH(l)═2NaHCO3(l)ΔH=-(8x-2y)kJ?mol-1 發布:2024/12/30 4:0:1組卷:142引用:5難度:0.7


