2021-2022學(xué)年山西省太原市高二(上)期中化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題(本題共20小題,每小題2分,共40分,在每小題給出的四個(gè)選項(xiàng)中,只有一項(xiàng)是符合題目要求的,請將正確選項(xiàng)填入答案欄內(nèi))
-
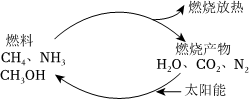 1.如果對燃燒產(chǎn)物如二氧化碳、水、氮?dú)獾壤锰柲苁顾鼈冎匦陆M合,可以節(jié)約燃料,緩解能源危機(jī)。在此構(gòu)想的物質(zhì)循環(huán)中太陽能最終轉(zhuǎn)化為( )
1.如果對燃燒產(chǎn)物如二氧化碳、水、氮?dú)獾壤锰柲苁顾鼈冎匦陆M合,可以節(jié)約燃料,緩解能源危機(jī)。在此構(gòu)想的物質(zhì)循環(huán)中太陽能最終轉(zhuǎn)化為( )A.化學(xué)能 B.熱能 C.生物質(zhì)能 D.電能 組卷:13引用:3難度:0.9 -
2.下列過程中化學(xué)反應(yīng)速率的加快對人類有益的是( )
A.金屬的腐蝕 B.食物的腐敗 C.塑料的降解 D.橡膠的老化 組卷:3引用:4難度:0.7 -
3.合成氨工業(yè)中采用了循環(huán)操作,主要原因是( )
A.加快反應(yīng)速率 B.提高NH3的平衡濃度 C.降低NH3的沸點(diǎn) D.提高N2、H2的利用率 組卷:12引用:4難度:0.9 -
4.古代詩詞中蘊(yùn)含著許多科學(xué)知識,下列敘述正確的是( )
A.“冰,水為之,而寒于水”說明等質(zhì)量的水和冰相比,冰的能量更高 B.于謙《石灰吟》“千錘萬鑿出深山,烈火焚燒若等閑”,描述的石灰石煅燒是吸熱反應(yīng) C.曹植《七步詩》“煮豆燃豆萁,豆在釜中泣”,這里的變化只有化學(xué)能轉(zhuǎn)化為熱能 D.蘇軾《石炭?并引》“投泥潑水愈光明,爍玉流金見精悍”,所指高溫時(shí)碳與水蒸氣反應(yīng)為放熱反應(yīng) 組卷:191引用:11難度:0.8 -
5.在密閉容器中進(jìn)行反應(yīng):H2(g)+Br2(g)?2HBr(g)。下列說法錯(cuò)誤的是( )
A.升高溫度,增加反應(yīng)物分子中活化分子的百分?jǐn)?shù) B.降低溫度,降低反應(yīng)物分子的能量 C.增大H2的濃度,單位體積內(nèi)活化分子數(shù)增加 D.增大壓強(qiáng),單位體積內(nèi)活化分子百分?jǐn)?shù)增加 組卷:2引用:1難度:0.7 -
6.已知室溫下:4Fe(OH)2+O2+2H2O=4Fe(OH)3反應(yīng)能自發(fā)進(jìn)行。對于該反應(yīng)的以下判斷正確的是( )
A.ΔH<0,ΔS<0 B.ΔH>0,ΔS<0 C.ΔH>0,ΔS>0 D.ΔH<0,ΔS>0 組卷:23引用:1難度:0.8 -
7.經(jīng)過化學(xué)家長期研究發(fā)現(xiàn)高爐中Fe2O3(s)+3CO(g)→2Fe(s)+3CO2(g)是可逆反應(yīng)。一定溫度下,在容積固定的容器中發(fā)生上述反應(yīng),下列情況能說明該反應(yīng)達(dá)到平衡的是( )
A.固體質(zhì)量不再減少 B.容器內(nèi)氣體壓強(qiáng)不再變化 C.氣體的物質(zhì)的量不再變化 D.v(CO)=v(CO2) 組卷:6引用:1難度:0.7 -
8.乙烯可由乙烷脫氫制得:C2H6(g)?C2H4(g)+H2(g)ΔH>0,在一定條件下反應(yīng)于密閉容器中達(dá)到平衡。下列各項(xiàng)措施中,既能加快化學(xué)反應(yīng)速率又能提高乙烷平衡轉(zhuǎn)化率的是( )
A.增大容器體積 B.升高溫度 C.分離出部分氫氣 D.恒壓下通入氦氣 組卷:4引用:1難度:0.5
三、選做題(以下兩組題任選一組題作答,共14分)
-
25.尿素[CO(NH2)2]對于我國經(jīng)濟(jì)和社會的可持續(xù)發(fā)展具有重要意義,工業(yè)上以NH3和CO2為原料合成:2NH3(g)+CO2(g)?CO(NH2)2(g)+H2O(g)。回答下列問題:
(1)已知上述反應(yīng)的平衡常數(shù)K和溫度T的關(guān)系如表所示:
①該反應(yīng)的ΔHT/℃ 165 175 185 K 111.9 74.1 50.6 0(填“>”或“<”,下同);該反應(yīng)中反應(yīng)物的總能量生成物的總能量。
②該反應(yīng)的平衡常數(shù)K的表達(dá)式為。
(2)傳統(tǒng)的尿素生產(chǎn)工藝耗能較高,且產(chǎn)率較低。最近我國科學(xué)家發(fā)現(xiàn)TiO2納米片負(fù)載的Pd-Cu合金納米顆粒電催化劑可以將水溶液中的CO2和N2直接轉(zhuǎn)化為尿素(反應(yīng)機(jī)理如圖所示,*表示催化劑活性中心原子)。
①根據(jù)以上反應(yīng)機(jī)理,*CO2→*COOH的過程發(fā)生(填“氧化反應(yīng)”或“還原反應(yīng)”);斷裂的是(填“極性鍵”或“非極性鍵”,下同),形成的是。
②與傳統(tǒng)生產(chǎn)工藝相比,這種新方法的優(yōu)點(diǎn)是。
(3)在2L的密閉容器中充入NH3和CO2模擬尿素的工業(yè)生產(chǎn),測得一定溫度和壓強(qiáng)下,CO2的平衡轉(zhuǎn)化率(α)與氨碳比x(即NH3和CO2的物質(zhì)的量之比)的關(guān)系如圖所示。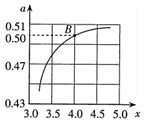
①計(jì)算圖中B點(diǎn)處NH3的平衡轉(zhuǎn)化率為。
②CO2平衡轉(zhuǎn)化率隨氨碳比增大而增大的原因是。組卷:15引用:1難度:0.6 -
26.當(dāng)今,世界多國相繼規(guī)劃了碳達(dá)峰、碳中和的時(shí)間節(jié)點(diǎn),我國力爭于2030年前做到碳達(dá)峰,2060年前實(shí)現(xiàn)碳中和。因此,研發(fā)二氧化碳利用技術(shù),降低空氣中二氧化碳的含量成為研究熱點(diǎn)。
(1)大氣中的二氧化碳主要來自于煤、石油及其他含碳化合物的燃燒。已知25℃時(shí),相關(guān)物質(zhì)的燃燒熱數(shù)據(jù)如下表:
則25℃時(shí)H2(g)和C(石墨,s)生成C6H6(l)的熱化學(xué)方程式為物質(zhì) H2(g) C(石墨,s) C6H6(l) 燃燒熱ΔH/(kJ?mol-1) -285.8 -393.5 -3267.5 。
(2)CH4與CO2重整是CO2利用的研究方向之一。該重整反應(yīng)體系主要涉及以下反應(yīng):
a.CH4(g)+CO2(g)?2CO(g)+2H2(g)ΔH1
b.H2(g)+CO2(g)?CO(g)+H2O(g)ΔH2
c.CH4(g)?C(s)+2H2(g)ΔH3
d.2CO(g)?C(s)+CO2(g)ΔH4
e.H2(g)+CO(g)?C(s)+H2O(g)ΔH5
①上述反應(yīng)體系在一定條件下建立平衡后,下列說法正確的有。(填字母)
A.增大CO2與CH4的濃度,反應(yīng)a、b、c的正反應(yīng)速率都增加
B.移去部分C(s),反應(yīng)c、d、e的平衡均向右移動
C.加入反應(yīng)a的催化劑,可提高CH4的平衡轉(zhuǎn)化率
D.降低反應(yīng)溫度,反應(yīng)a~e的正、逆反應(yīng)速率都減小
②一定條件下,CH4分解形成碳的反應(yīng)歷程如圖所示。該歷程經(jīng)歷了步反應(yīng),其中第步的正反應(yīng)速率最慢。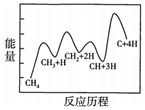
(3)以CO2、H2為原料合成CH3OH的主要反應(yīng)如下:
Ⅰ.3H2(g)+CO2(g)?CH3OH(g)+H2O(g)ΔH1=-49.5kJ?mol-1
Ⅱ.2H2(g)+CO(g)?CH3OH(g)ΔH2=-90.4kJ?mol-1
Ⅲ.H2(g)+CO2(g)?CO(g)+H2O(g)ΔH3=+40.9kJ?mol-1
不同壓強(qiáng)下,按照n(CO2):n(H2)=1:3投料,實(shí)驗(yàn)測得CO2的平衡轉(zhuǎn)化率和CH3OH的平衡產(chǎn)率隨溫度的變化關(guān)系如圖所示。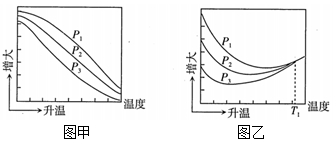
已知:CO2的平衡轉(zhuǎn)化率=×100%n(CO2)初始-n(CO2)平衡n(CO2)初始
CH3OH的平衡產(chǎn)率=×100%n(CH3OH)平衡n(CO2)初始
其中縱坐標(biāo)表示CO2平衡轉(zhuǎn)化率的是圖(填“甲”或“乙”);壓強(qiáng)P1、P2、P3由大到小的順序?yàn)?;圖乙中T1溫度時(shí),三條曲線幾乎交于一點(diǎn)的原因是。
(4)恒壓下,按照n(CO2):n(H2)=1:3投料發(fā)生反應(yīng)Ⅰ,該反應(yīng)在無分子篩膜時(shí)甲醇的平衡產(chǎn)率和有分子篩膜時(shí)甲醇的平衡產(chǎn)率隨溫度的變化如圖所示(分子篩膜具有選擇透過性)。P點(diǎn)甲醇的平衡產(chǎn)率高于T點(diǎn)的原因可能是。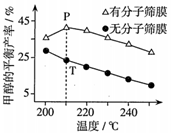 組卷:13引用:1難度:0.6
組卷:13引用:1難度:0.6


