 前四周期元素A、B、C、D、E的原子序數(shù)依次增大,A元素原子的核外電子只有一種運(yùn)動(dòng)狀態(tài);基態(tài)B原子s能級(jí)的電子總數(shù)比p能級(jí)的多1;基態(tài)C原子和基態(tài)E原子中成對(duì)電子數(shù)均是未成對(duì)電子數(shù)的3倍;D形成簡(jiǎn)單離子的半徑在同周期元素形成的簡(jiǎn)單離子中最小。回答下列問題:
前四周期元素A、B、C、D、E的原子序數(shù)依次增大,A元素原子的核外電子只有一種運(yùn)動(dòng)狀態(tài);基態(tài)B原子s能級(jí)的電子總數(shù)比p能級(jí)的多1;基態(tài)C原子和基態(tài)E原子中成對(duì)電子數(shù)均是未成對(duì)電子數(shù)的3倍;D形成簡(jiǎn)單離子的半徑在同周期元素形成的簡(jiǎn)單離子中最小。回答下列問題:
(1)E的元素名稱為 鉻鉻。
(2)元素A、B、C中,電負(fù)性最大的是 OO(填元素符號(hào),下同),元素B、C、D第一電離能由大到小的順序?yàn)?N>O>AlN>O>Al。
(3)與同族其他元素X形成的XA3相比,BA3易液化的原因是 氨氣分子之間形成氫鍵氨氣分子之間形成氫鍵;BA3分子中鍵角 <<(填“>”“<”或“=”)109°28′。
(4)BC-3中B原子軌道的雜化類型為 sp2sp2,BC-3的空間結(jié)構(gòu)為 平面三角形平面三角形。
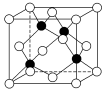
(5)化合物DB是人工合成的半導(dǎo)體材料,它的晶胞結(jié)構(gòu)與金剛石(晶胞結(jié)構(gòu)如圖所示)相似。若DB的晶胞參數(shù)為apm,則晶體的密度為 4×41NA×(a×10-10)34×41NA×(a×10-10)3 g?cm-3(用NA表示阿伏加德羅常數(shù)的值)。
BC
-
3
BC
-
3
4
×
41
N
A
×
(
a
×
1
0
-
10
)
3
4
×
41
N
A
×
(
a
×
1
0
-
10
)
3
【答案】鉻;O;N>O>Al;氨氣分子之間形成氫鍵;<;sp2;平面三角形;
4
×
41
N
A
×
(
a
×
1
0
-
10
)
3
【解答】
【點(diǎn)評(píng)】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:59引用:4難度:0.5
相似題
-
1.短周期主族元素X、Y、Z、W的原子序數(shù)依次增大,X與W同主族,X、W可以分別與Z形成原子個(gè)數(shù)比為1:1、2:1的兩種化合物,Y與Z可以形成多種化合物,其中某些化合物是常見的空氣污染物。下列說(shuō)法正確的是( )
A.簡(jiǎn)單離子半徑的大小關(guān)系:r(W)>r(Y)>r(Z) B.X與Z形成的化合物都具有較強(qiáng)的熱穩(wěn)定性 C.簡(jiǎn)單氫化物的沸點(diǎn):Y<Z D.化合物X2Z2與W2Z2所含化學(xué)鍵類型完全相同 發(fā)布:2025/1/6 7:30:5組卷:49引用:3難度:0.5 -
2.短周期元素的離子aA2+、bB+、cC3-、dD-具有相同的電子層結(jié)構(gòu),則下列敘述正確的是( )
A.電負(fù)性:A>B>C>D B.原子序數(shù):d>c>b>a C.離子半徑:C3->D->B+>A2+ D.元素的第一電離能:A>B>D>C 發(fā)布:2025/1/6 6:0:5組卷:15引用:9難度:0.9 -
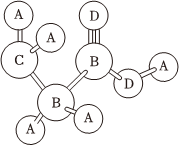 3.共價(jià)化合物分子中各原子有一定的連接方式,某分子可用球棍模型表示如圖,A的原子半徑最小,C、D位于同周期,D的常見單質(zhì)常溫下為氣態(tài),下列說(shuō)法正確的是( )
3.共價(jià)化合物分子中各原子有一定的連接方式,某分子可用球棍模型表示如圖,A的原子半徑最小,C、D位于同周期,D的常見單質(zhì)常溫下為氣態(tài),下列說(shuō)法正確的是( )A.B的同素異形體數(shù)目最多2種 B.A與C不可以形成離子化合物 C.通過(guò)含氧酸酸性可以比較元素B和C的非金屬性 D.C與D形成的陰離子 既有氧化性,又有還原性CD-2發(fā)布:2025/1/6 6:0:5組卷:47引用:4難度:0.5


