SO2、NOx是空氣的主要污染物,有效去除大氣中的SO2、NOx可以保護大氣環境。含氮廢水氨氮(以NH3、NH+4存在)和硝態氮(以NO-2、NO-3存在)引起水體富營養化,需經處理后才能排放。
(1)用天然堿生產小蘇打的母液(主要溶質為碳酸鈉)吸收煙氣中SO2的相關反應的熱化學方程式如下:
2Na2CO3(aq)+SO2(g)+H2O(l)═Na2SO3(aq)+2NaHCO3(aq) ΔH=akJ?mol-1
2NaHCO3(aq)+SO2(g)═Na2SO3(aq)+2CO2(g)+H2O(l) ΔH=bkJ?mol-1
Na2SO3(aq)+SO2(g)+H2O(l)═2NaHSO3(aq) ΔH=ckJ?mol-1
反應Na2CO3(aq)+SO2(g)═Na2SO3(aq)+CO2(g)的ΔH=(a+b)2(a+b)2kJ?mol-1。
(2)工業上用電解法治理亞硝酸鹽對水體的污染,模擬工藝如圖1所示,寫出電解時鐵電極發生的電極反應式:①Fe-2e-═Fe2+Fe-2e-═Fe2+。隨后,鐵電極附近有無色氣體產生,寫出有關反應的離子方程式:②2NO-2+8H++6Fe2+═N2↑+6Fe3++4H2O2NO-2+8H++6Fe2+═N2↑+6Fe3++4H2O。
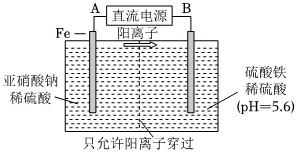
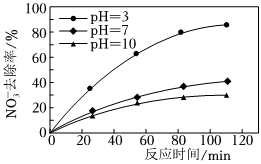
(3)工業上以鈦基氧化物涂層材料為陽極、碳納米管修飾的石墨為陰極,電解硝酸鈉和硫酸鈉混合溶液,可使NO-3,變為NH+4。電極(電催化劑)所處的環境對其催化活性起重要作用。其他條件不變,向其中一份電解液中投加一定量NaCl,去除NH+4的效果明顯提高,溶液中氮元素含量顯著降低。可能原因是①水中的氯離子在陽極上被氧化成氯氣,氯氣與銨離子發生氧化反應生成N2,從而使銨離子從水溶液中得到去除水中的氯離子在陽極上被氧化成氯氣,氯氣與銨離子發生氧化反應生成N2,從而使銨離子從水溶液中得到去除。其他條件不變,只改變溶液的pH,NO-3去除率如圖2所示,pH升高時,去除率②下降下降(“升高”或“下降”),可能原因是③隨著pH的升高,催化劑的催化活性明顯下降隨著pH的升高,催化劑的催化活性明顯下降。
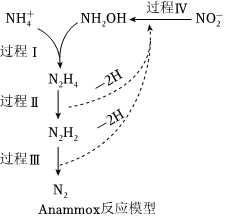
(4)厭氧氨化法(Anammox)是一種新型的氨氮去除技術,反應模型如圖所示。氨氮去除過程總的離子方程式為:NH+4+NO-2═N2↑+2H2ONH+4+NO-2═N2↑+2H2O。
NH
+
4
NO
-
2
NO
-
3
(
a
+
b
)
2
(
a
+
b
)
2
NO
-
2
NO
-
2
NO
-
3
NH
+
4
NH
+
4
NO
-
3
NH
+
4
NO
-
2
NH
+
4
NO
-
2
【考點】電解原理;“三廢”處理與環境保護.
【答案】;Fe-2e-═Fe2+;2+8H++6Fe2+═N2↑+6Fe3++4H2O;水中的氯離子在陽極上被氧化成氯氣,氯氣與銨離子發生氧化反應生成N2,從而使銨離子從水溶液中得到去除;下降;隨著pH的升高,催化劑的催化活性明顯下降;+═N2↑+2H2O
(
a
+
b
)
2
NO
-
2
NH
+
4
NO
-
2
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:77引用:5難度:0.6
相似題
-
1.鈰(Ce)是鑭系金屬元素。空氣污染物NO通常用含Ce4+的溶液吸收,生成HNO2、
,再利用電解法將上述吸收液中的HNO2轉化為無毒物質,同時生成Ce4+,其原理如圖所示。下列說法正確的是( )NO-3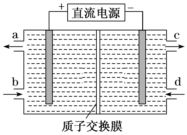
A.H+由右室進入左室 B.Ce4+從電解槽的c口流出,且可循環使用 C.陰極的電極反應式:2HNO2+6H++6e-═N2↑+4H2O D.若用甲烷燃料電池作為電源,當消耗標準狀況下33.6L甲烷時,理論上可轉化2mol HNO2 發布:2025/1/6 7:30:5組卷:129引用:7難度:0.7 -
2.(NH4)2S2O8電化學循環氧化法可用于廢水中苯酚的降解,示意圖如圖。
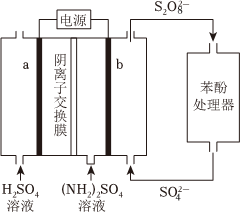
(1)(NH4)2S2O8的電解法制備。
已知:電解效率η的定義為η(B)=×100%。n(生成B所用的電子)n(通過電極的電子)
①電極b是極。
②生成S2的電極反應式是O2-8。
③向陽極室和陰極室各加入100mL溶液。制備S2的同時,還在電極b表面收集到2.5×10-4mol氣體,氣體是O2-8。經測定η(S2)為80%,不考慮其他副反應,則制備的(NH4)2S2O8的物質的量濃度為O2-8mol/L。
(2)苯酚的降解
已知:?具有強氧化性,Fe2+性度較高時會導致SO-4?猝滅。S2SO-4可將苯酚氧化為CO2,但反應速率較慢。加入Fe2+可加快反應,過程為:O2-8
i.S2+Fe2+═O2-8+SO2-4?+Fe3+SO-4
ii.?將苯酚氧化SO-4
①?氧化苯酚的離子方程式是SO-4。
②將電解得到的含S2溶液稀釋后加入苯酚處理器,調節溶液總體積為1L,pH=1,測得在相同時間內,不同條件下苯酚的降解率如圖。O2-8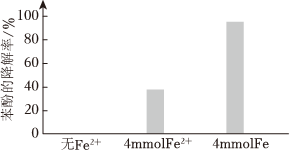
用等物質的量的鐵粉代替FeSO4,可明顯提高苯酚的降解率,主要原因是。
(3)苯酚殘留量的測定
已知:電解中轉移1mol電子所消耗的電量為F庫侖。
取處理后的水樣100mL,酸化后加入KBr溶液,通電。電解產生的Br2全部與苯酚反應,當苯酚完全反應時,消耗的電量為a庫侖,則樣品中苯酚的含量為g/L。(苯酚的摩爾質量:94g/mol)發布:2024/12/30 11:30:1組卷:165引用:3難度:0.4 -
3.如圖所示,某同學設計一個甲醚(CH3OCH3)燃料電池并探究氯堿工業原理和粗銅的精煉原理,其中乙裝置中X為陽離子交換膜。
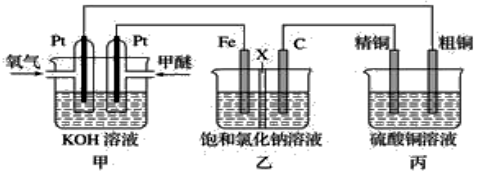
(1)通入氧氣的電極為極,寫出負極電極反應式。
(2)鐵電極為極,石墨電極(C)的電極反應式為。
(3)反應一段時間后,乙裝置中生成NaOH主要在(填“鐵極”或“石墨極”)區。
(4)如果粗銅中含有鋅、銀等雜質,丙裝置中陽極上電極反應式為,反應一段時間,硫酸銅溶液濃度將(填“增大”、“減小”或“不變”)發布:2025/1/3 8:0:1組卷:6引用:1難度:0.6


