綠礬(FeSO4?7H2O)在化學合成上用作還原劑及催化劑.工業上常用廢鐵屑溶于一定濃度的硫酸溶液制備綠礬.
(1)98% 1.84g/cm3的濃硫酸在稀釋過程中,密度下降,當稀釋至50%時,密度為1.4g/cm3,50%的硫酸物質的量濃度為7.14 mol?L-17.14 mol?L-1(保留兩位小數),50%的硫酸與30%的硫酸等體積混合,混合酸的濃度為>>(填>、<、=)40%.
(2)將111.2g綠礬(FeSO4?7H2O,式量為278)在高溫下加熱,充分反應后生成Fe2O3固體和SO2、SO3、水的混合氣體,則生成Fe2O3的質量為3232g;SO2為0.20.2mol.
實驗室可用以下方法制備摩爾鹽晶體.
(3)將4.88g鐵屑(含Fe2O3)與25mL 3mol/L H2SO4充分反應后,得到 FeSO4和H2SO4的混合溶液,稀釋溶液至100mL,測得其pH=1.鐵屑中Fe2O3的質量分數是0.66(或66%)0.66(或66%)(保留兩位小數).
(4)向上述100mL溶液中加入與該溶液中FeSO4等物質的量的(NH4)2SO4晶體,待晶體完全溶解后蒸發掉部分水,冷卻至t℃,析出摩爾鹽晶體12.360g,剩余溶液的質量為82.560g.t℃時,計算(NH4)2SO4?FeSO4?6H2O的溶解度22.35g22.35g.(保留兩位小數).
【考點】物質的量濃度的相關計算.
【答案】7.14 mol?L-1;>;32;0.2;0.66(或66%);22.35g
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:73引用:2難度:0.1
相似題
-
1.用25mL 18.4mol/L的濃硫酸與銅共熱一段時間后,冷卻,過濾除去多余的銅,將濾液稀釋到100mL,所得溶液中
濃度為3mol/L,則此時溶液中CuSO4的物質的量濃度為( )SO2-4A.0.5mol/L B.1.6 mol/L C.1.8 mol/L D.3mol/L 發布:2024/12/30 4:0:1組卷:138引用:6難度:0.5 -
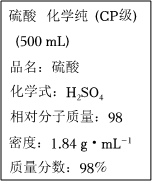 2.如圖是硫酸試劑標簽上的部分內容,據此下列說法正確的是( )
2.如圖是硫酸試劑標簽上的部分內容,據此下列說法正確的是( )A.該硫酸試劑的物質的量濃度為18.4mol?L-1 B.該硫酸可以干燥H2S等酸性氣體,但不可以干燥NH3 C.50mL該H2SO4中加入足量的銅片并加熱,被還原的H2SO4的物質的量為0.46mol D.2.7g Al與足量的該硫酸反應可得到H23.36L 發布:2024/12/30 4:30:1組卷:79引用:3難度:0.8 -
3.標準狀況下,將一充滿HCl氣體的燒瓶倒扣在盛有水的水槽中,HCl氣體被完全吸收,假設溶液沒有損失,則燒瓶內所得溶液的物質的量濃度為( )
A.0.045 mol/L B.1 mol/L C.0.5 mol/L D.2.24mol/L 發布:2024/12/30 6:0:2組卷:17引用:3難度:0.7


