2020-2021學(xué)年黑龍江省哈爾濱六中高一(下)開學(xué)化學(xué)試卷
發(fā)布:2024/11/21 5:0:1
一、選擇題(共25小題,每小題2分,滿分50分)
-
1.《夢溪筆談》中記載:“解州鹽澤鹵色正赤,在版泉之下,俚俗謂之‘蚩尤血’.唯巫咸水人,則鹽不復(fù)結(jié),故人謂之‘無咸河原其理,蓋巫咸乃濁水,人鹵中,則淤淀鹵脈,鹽遂不成,非有他異也’”。下列有關(guān)說法正確的是( )
A.“鹵色正赤”的原因?yàn)樗泻蠪e2+ B.“巫咸水乃濁水”指巫咸水是懸濁液 C.“巫咸水入鹵中”發(fā)生了膠體的聚沉 D.解州鹽澤帶負(fù)電荷,巫咸水帶正電荷 組卷:107引用:3難度:0.8 -
2.下列物質(zhì)中,不屬于合金的是( )
A.硬鋁 B.黃銅 C.鋼鐵 D.金 組卷:40引用:10難度:0.6 -
3.下列關(guān)于膠體和溶液的敘述正確的是( )
A.溶液呈電中性,部分膠體帶電荷,部分膠體不帶電荷 B.膠體與其他分散系的本質(zhì)區(qū)別是能否產(chǎn)生丁達(dá)爾效應(yīng) C.氫氧化鐵膠體是一種紅褐色的液體 D.膠體是具有一定穩(wěn)定性的分散劑 組卷:121引用:5難度:0.8 -
4.用光潔的鉑絲蘸取無色溶液,在無色燈焰上灼燒時(shí)觀察到黃色火焰,則下列有關(guān)敘述正確的是( )
A.只含有Na+ B.一定含Na+也可含K+ C.既含Na+又含有K+ D.可能含Na+或K+中一種 組卷:733引用:34難度:0.9 -
5.只用一種試劑可鑒別K2SO4、MgCl2、FeCl2、(NH4)2SO4四種溶液,這種試劑是( )
A.Ba(OH)2 B.H2SO4 C.NaOH D.AgNO3 組卷:20引用:4難度:0.7 -
6.鐵屑溶于過量稀硫酸,過濾后向?yàn)V液中加入過量氨水,有白色沉淀生成,過濾,在空氣中加熱沉淀至質(zhì)量不再發(fā)生變化為止,得到紅棕色殘?jiān)鲜龀恋砗蜌堅(jiān)謩e是( )
A.Fe(OH)2 Fe(OH)3 Fe2O3 B.Fe(OH)2 Fe(OH)3 Fe3O4 C.Fe(OH)2 Fe(OH)3 Fe(OH)3 D.Fe(OH)3 Fe(OH)2 FeO 組卷:196引用:4難度:0.5 -
7.為了除去硫酸銅溶液中的硫酸亞鐵雜質(zhì),通常先加入合適的氧化劑使Fe2+轉(zhuǎn)化為Fe3+下列物質(zhì)中合適的是( )
A.KMnO4溶液 B.H2O2溶液 C.氯水 D.HNO3溶液 組卷:47引用:6難度:0.5 -
8.已知反應(yīng)8NH3+3Cl2═N2+6NH4Cl。下列化學(xué)用語表述錯(cuò)誤的是( )
A.Cl-的結(jié)構(gòu)示意圖: 
B.N2的結(jié)構(gòu)式:N≡N C.NH4+的電子式: 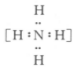
D.氧化性:Cl2>N2 組卷:14引用:2難度:0.8 -
9.等體積、等物質(zhì)的量濃度的硫酸、氫氧化鈉溶液分別放在甲、乙兩燒杯中,各加入等質(zhì)量的鋁,生成氫氣的體積比為5:6,則甲、乙兩燒杯中的反應(yīng)情況可能分別是( )
A.甲、乙中都是鋁過量 B.甲中鋁過量,乙中堿過量 C.甲中酸過量,乙中鋁過量 D.甲中酸過量,乙中堿過量 組卷:1835引用:44難度:0.5
二、解答題(共4小題,滿分50分)
-
28.鐵是應(yīng)用最廣泛的金屬,鐵的鹵化物、氧化物以及高價(jià)鐵的含氧酸鹽均為重要化合物。
(1)要確定鐵的某氯化物FeClx的化學(xué)式。實(shí)驗(yàn)中稱取0.54g的FeClx樣品,溶解后先進(jìn)行陽離子交換預(yù)處理,再通過含有飽和OH-的陰離子交換柱,使Cl-和OH-完全發(fā)生交換。交換完成后,流出溶液的OH-恰好被用0.40mol?L-1的鹽酸25.00mL完全中和。計(jì)算FeClx中x值為;(保留整數(shù))
(2)現(xiàn)有一含有FeCl2和FeCl3的混合物樣品,采用上述方法測得n(Fe):n(Cl)=1:2.1,則該樣品中FeCl3的物質(zhì)的量分?jǐn)?shù)為。在實(shí)驗(yàn)室中,F(xiàn)eCl2可用鐵粉和反應(yīng)制備,F(xiàn)eCl3可用鐵粉和反應(yīng)制備;
(3)FeCl3與氫碘酸反應(yīng)時(shí)可生成棕色物質(zhì),該反應(yīng)的離子方程式為;
(4)高鐵酸鉀(K2FeO4)是一種強(qiáng)氧化劑,可作為水處理劑和高容量電池材料。FeCl3與KClO在強(qiáng)堿性條件下反應(yīng)可制取K2FeO4,其反應(yīng)的離子方程式為。組卷:85引用:2難度:0.5 -
29.綠礬(FeSO4?7H2O)在化學(xué)合成上用作還原劑及催化劑.工業(yè)上常用廢鐵屑溶于一定濃度的硫酸溶液制備綠礬.
(1)98% 1.84g/cm3的濃硫酸在稀釋過程中,密度下降,當(dāng)稀釋至50%時(shí),密度為1.4g/cm3,50%的硫酸物質(zhì)的量濃度為(保留兩位小數(shù)),50%的硫酸與30%的硫酸等體積混合,混合酸的濃度為(填>、<、=)40%.
(2)將111.2g綠礬(FeSO4?7H2O,式量為278)在高溫下加熱,充分反應(yīng)后生成Fe2O3固體和SO2、SO3、水的混合氣體,則生成Fe2O3的質(zhì)量為g;SO2為mol.
實(shí)驗(yàn)室可用以下方法制備摩爾鹽晶體.
(3)將4.88g鐵屑(含F(xiàn)e2O3)與25mL 3mol/L H2SO4充分反應(yīng)后,得到 FeSO4和H2SO4的混合溶液,稀釋溶液至100mL,測得其pH=1.鐵屑中Fe2O3的質(zhì)量分?jǐn)?shù)是(保留兩位小數(shù)).
(4)向上述100mL溶液中加入與該溶液中FeSO4等物質(zhì)的量的(NH4)2SO4晶體,待晶體完全溶解后蒸發(fā)掉部分水,冷卻至t℃,析出摩爾鹽晶體12.360g,剩余溶液的質(zhì)量為82.560g.t℃時(shí),計(jì)算(NH4)2SO4?FeSO4?6H2O的溶解度.(保留兩位小數(shù)).組卷:73引用:2難度:0.1


