某研究小組進行Mg(OH)2沉淀、溶解和轉化的實驗探究。
室溫下,向3支盛有1mL1mol/L的MgCl2溶液中各加入10滴2mol/LNaOH,制得等量Mg(OH)2沉淀;然后分別向其中加入不同試劑,記錄實驗現象如下表:
| 實驗1 | 實驗2:加入試劑 | 實驗現象 |
取三支試管分別做該實驗,再分別作實驗2 |
ⅰ.4mL2.0mol/LNH4Cl溶液 | 沉淀溶解 |
| ⅱ.4mL蒸餾水 | 沉淀不溶解 | |
| ⅲ.10滴0.1mol/L的FeCl3溶液,靜置 |
白色沉淀轉化為紅褐色沉淀 白色沉淀轉化為紅褐色沉淀 。 |
10-4
10-4
mol/L。(2)實驗ⅱ的目的是:
對照實驗
對照實驗
。(3)實驗ⅲ的現象是:
白色沉淀轉化為紅褐色沉淀
白色沉淀轉化為紅褐色沉淀
,用化學用語表示該現象的原因:3Mg(OH)2(s)+2Fe3+(aq)?3Mg2+(aq)+2Fe(OH)3(s)
3Mg(OH)2(s)+2Fe3+(aq)?3Mg2+(aq)+2Fe(OH)3(s)
。(4)推測實驗ⅰ中沉淀溶解的原因。
推測1:NH4Cl溶液顯酸性,溶液中的H+可以結合OH-。
推測2:
溶液中c()較大,結合OH-使沉淀溶解
NH
+
4
NH
+
4
溶液中c()較大,結合OH-使沉淀溶解
。NH
+
4
NH
+
4
(5)為探究ⅰ中沉淀溶解的原因,小組同學繼續進行實驗:取4mL2.0mol/LNH4Cl溶液,向其中滴加2滴濃氨水,得到pH=8的混合溶液,再向同樣的Mg(OH)2沉淀中加入該溶液,沉淀溶解。上述實驗結果證明(4)中
推測2
推測2
成立,寫出發生反應的離子方程式:Mg(OH)2+2=2NH3?H2O+Mg2+
NH
+
4
Mg(OH)2+2=2NH3?H2O+Mg2+
。NH
+
4
【考點】探究沉淀溶解.
【答案】白色沉淀轉化為紅褐色沉淀;10-4;對照實驗;白色沉淀轉化為紅褐色沉淀;3Mg(OH)2(s)+2Fe3+(aq)?3Mg2+(aq)+2Fe(OH)3(s);溶液中c()較大,結合OH-使沉淀溶解;推測2;Mg(OH)2+2=2NH3?H2O+Mg2+
NH
+
4
NH
+
4
NH
+
4
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:98引用:2難度:0.5
相似題
-
1.常溫下,某小組同學用如圖裝置探究Mg(OH)2的沉淀溶解平衡。
Ⅰ.實驗①測得電導率隨時間變化的曲線如圖1所示。實驗裝置 實驗序號 傳感器種類 實驗操作 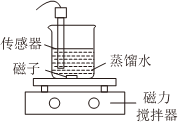
① 電導率傳感器 向蒸餾水中加入足量Mg(OH)2粉末,一段時間后再加入少量蒸餾水 ② pH傳感器 向滴有酚酞的蒸餾水中加入Mg(OH)2粉末,隔一段時間后,再向所得懸濁液中加入一定量稀硫酸
已知:ⅰ.在稀溶液中,離子濃度越大,電導率越大。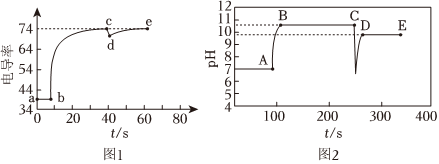 (1)a點電導率不等于0的原因是水能發生 。
(1)a點電導率不等于0的原因是水能發生 。
(2)由圖1可知,在Mg(OH)2懸濁液中加入少量水的時刻為(填“b”、“c”或“d”)點。
(3)分析電導率在de段逐漸上升的原因:d時刻,Q[Mg(OH)2](填“>”、“<”或“=”)Ksp[Mg(OH)2],導致(結合沉淀溶解平衡解釋原因)。
Ⅱ.實驗②測得pH隨時間變化的曲線如圖2所示。
已知:ⅱ.25℃,Ksp[Mg(OH)2]=5.6×10-12
ⅲ.酚酞的變色范圍:
(4)依據圖2可判斷:A點加入的Mg(OH)2的物質的量大于C點加入的硫酸的物質的量,判據是pH <8.2 8.2~10 >10 顏色 無色 淡粉色 紅色 。
(5)0~300s時,實驗②中溶液先變紅,后。
(6)Mg(OH)2常被用于水質改良劑,能夠使水體pH約為9,進而抑制細菌的生長。25℃時水體中c(Mg2+)約為mol?L-1。發布:2024/4/20 14:35:0組卷:98引用:6難度:0.7 -
2.某研究小組進行Mg(OH)2沉淀溶解和生成的實驗探究。
(查閱資料)25℃時,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38
(實驗探究)向2支均盛有1mL 0.1mol/L MgCl2溶液的試管中分別加入2滴2mol/L NaOH溶液,制得等量Mg(OH)2沉淀。
(1)分別向兩支試管中加入不同試劑,記錄實驗現象如表:(表中填空填下列選項中字母代號)
A、白色沉淀轉化為紅褐色沉淀試管編號 加入試劑 實驗現象 Ⅰ 2滴0.1mol/L FeCl3溶液 ① Ⅱ 4mL 2mol/L NH4Cl溶液 ②
B、白色沉淀不發生改變
C、紅褐色沉淀轉化為白色沉淀
D、白色沉淀溶解,得無色溶液
(2)測得試管Ⅰ中所得混合液pH=6,則溶液中c(Fe3+)=。
(3)同學們猜想實驗Ⅱ中沉淀溶解的主要原因有兩種:
猜想1:NH4+結合Mg(OH)2電離出的OH-,使Mg(OH)2的溶解平衡正向移動。
猜想2:。
(4)為驗證猜想,同學們取少量相同質量的氫氧化鎂盛放在兩支試管中,一支試管中加入醋酸銨溶液(pH=7),另一支試管中加入NH4Cl和氨水混合液(pH=8),兩者沉淀均溶解。該實驗證明猜想正確的是(填“1”或“2”)。發布:2024/4/20 14:35:0組卷:193引用:5難度:0.5 -
3.某興趣小組為探究沉淀溶解平衡的原理并測定某溫度下PbI2溶度積常數,設計如下實驗。
Ⅰ取100mL蒸餾水,加入過量的PbI2固體(黃色),攪拌,靜置,過濾到潔凈的燒杯中,得到濾液。
(1)攪拌的目的是。
(2)取少量濾液于試管中,向其中滴加幾滴0.1mol?L-1 KI溶液,觀察到的現象是,溶液中c(Pb2+)(填“增大”、“減小”或“不變”)。
Ⅱ準確量取10.00mL濾液,與離子交換樹脂(RH)發生反應:2RH+Pb2+=R2Pb+2H+,交換完成后,流出溶液用中和滴定法測得n(H+)=3.000×10-5mol。
(3)在此實驗溫度下,PbI2的溶度積常數Ksp=。
(4)若步驟Ⅰ盛裝濾液的燒杯中有少量水,Ksp測定結果將會(填“偏大”、“偏小”或“無影響”)。發布:2024/4/20 14:35:0組卷:167引用:6難度:0.5


