 25℃時(shí),三種酸的電離平衡常數(shù)如表所示。
25℃時(shí),三種酸的電離平衡常數(shù)如表所示。
| 化學(xué)式 | CH3COOH | HClO | H3PO3 |
| 名稱(chēng) | 醋酸 | 次氯酸 | 亞磷酸 |
| 電離平衡常數(shù) | 1.8×10-5 | 3.0×10-8 | K1=8.3×10-3 K2=5.6×10-6 |
(1)濃度均為0.1mol/L的CH3COOH、HClO、H3PO3溶液中,c(H+)由大到小的排列是
H3PO3、CH3COOH、HClO
H3PO3、CH3COOH、HClO
。(2)亞磷酸(H3PO3)為二元酸,具有較強(qiáng)的還原性Na2HPO3是
正鹽
正鹽
(填“酸式鹽”“堿式鹽”或“正鹽”)。此時(shí)亞磷酸的電離平衡常數(shù)表達(dá)式K=c
(
H
+
)
c
(
HP
O
2
-
3
)
c
(
H
2
P
O
-
3
)
c
(
H
+
)
c
(
HP
O
2
-
3
)
c
(
H
2
P
O
-
3
)
(3)常溫下,0.1mol/L的CH3COOH溶液加水稀釋的過(guò)程中,下列表達(dá)式的數(shù)值變大的是
B
B
(填字母)。A.c(H+)
B.
c
(
H
+
)
c
(
C
H
3
COOH
)
C.c(CH3COO-)
D.c(CH3COOH)
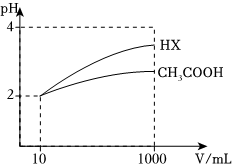
(4)體積為10mL、pH=2的醋酸溶液與一元酸HX分別加水稀釋至1000mL,稀釋過(guò)程pH變化如圖,則HX的電離平衡常數(shù)
大于
大于
(填“大于”“小于”或“等于”,下同)醋酸的電離平衡常數(shù)。稀釋后,HX溶液中水電離出來(lái)的c(H+) 大于
大于
醋酸溶液中水電離出來(lái)的c(H+)。【考點(diǎn)】弱電解質(zhì)的電離平衡.
【答案】H3PO3、CH3COOH、HClO;正鹽;;B;大于;大于
c
(
H
+
)
c
(
HP
O
2
-
3
)
c
(
H
2
P
O
-
3
)
【解答】
【點(diǎn)評(píng)】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書(shū)面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:7引用:2難度:0.7
相似題
-
1.25℃時(shí),用蒸餾水稀釋0.10mol?L-1的醋酸,若用KW表示水的離子積常數(shù),則下列各式表 示的數(shù)值隨水量的增加而增大的是( )
A. [CH3COOH][H+]B. [CH3COO-][CH3COOH]C. [H+]kWD. [H+][OH-]發(fā)布:2025/1/1 8:0:2組卷:1引用:1難度:0.7 -
2.用水稀釋0.1mol/L的醋酸溶液,其中隨加水量的增加而增大的有( )
A.C(CH3COOH) B.C(H+) C.C(H+)/C(CH3COOH) D.C(CH3COOH)/C(H+) 發(fā)布:2025/1/1 8:0:2組卷:3引用:1難度:0.9 -
3.將0.1mol?L-1的醋酸溶液加水稀釋?zhuān)瑒t( )
A.中和此溶液所需的0.1 mol?L-1 NaOH溶液的體積增加 B.c(CH3COOH)減小,平衡向電離方向移動(dòng),c(CH3COO-)增大 C.平衡向電離方向移動(dòng),c(CH3COOH)、c(H+)、c(OH-)、c(CH3COO-)均減小 D.電離程度增大,由CH3COOH電離出的n(H+)變大 發(fā)布:2025/1/1 8:0:2組卷:6引用:1難度:0.7


