2021-2022學年江蘇省南通市海安市李堡中學高二(上)期中化學試卷
發(fā)布:2024/4/20 14:35:0
一、單項選擇題:本題包括14小題,每小題3分,共計42分。每小題只有一個選項符合題意。
-
1.化學與生產(chǎn)、生活關(guān)系密切,下列做法與調(diào)控化學反應速率無關(guān)的是( )
A.合成氨時使用鐵觸媒 B.用熱的純堿溶液去除油污 C.乘坐公共交通工具時需佩戴口罩 D.將聚餐打包的食物放入冰箱中 組卷:34引用:4難度:0.7 -
2.下列關(guān)于化學反應與能量的說法正確的是( )
A.已知正丁烷的燃燒熱為2878kJ?mol-1,則表示正丁烷燃燒熱的熱化學方程式為:2CH3 CH2CH2CH3(g)+13O2 (g)═8CO2 (g)+10H2O(l)△H=-2878 kJ?mol-1 B.已知在一定條件下,2 mol SO2與1molO2充分反應后,釋放出98kJ的熱量,則其熱化學方程式為:2SO2(g)+O2(g)?2SO3(g)△H=-98kJ?mol-1 C.已知稀鹽酸與稀NaOH溶液反應的中和熱為57.3kJ?mol-1,則表示稀硫酸與稀NaOH溶液反應的熱化學方程式為: H2SO4(aq)+NaOH(aq)═12Na2SO4(aq)+H2O(l)△H=-57.3kJ?mol-112D.已知CuSO4(s)+5H2O(l)═CuSO4?5H2O(s),該反應為熵增加的反應 組卷:78引用:4難度:0.7 -
3.勒夏特列原理是平衡移動問題的指揮棒,下列事實不能用勒夏特列原理解釋的是( )
A.打開碳酸飲料會有大量氣泡冒出,實驗室用排飽和食鹽水的方法收集氯氣 B.對于2HI(g)?H2(g)+I2(g),達到平衡后,縮小容器體積可使體系顏色變深 C.反應CO(g)+NO2(g)?CO2(g)+NO(g)(正反應為放熱反應),達到平衡后,升高溫度體系顏色變深 D.工業(yè)制取金屬鉀Na(l)+KCl(l)?NaCl(l)+K(g),選取適宜的溫度,使鉀成蒸氣從反應混合物中分離出來 組卷:13引用:3難度:0.7 -
4.目前人工固氮普遍采用的是氨的工業(yè)合成。化學家GethardErtl證實了氫氣與氮氣在固體催化劑表面合成氨的過程,如圖所示。下列說法錯誤的是( )
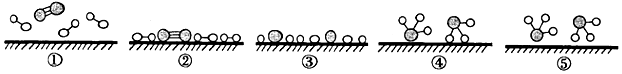
A.②→③需要吸收能量 B.為了提高氨的脫附速率,應適時地將氨從反應后的混合氣體中分離出來 C.該過程中包含舊化學鍵的斷裂和新化學鍵的生成 D.該催化劑可提高反應物的平衡轉(zhuǎn)化率 組卷:69引用:2難度:0.8 -
5.室溫下,下列各組離子在指定溶液中能大量共存的是( )
A. =10-12的溶液:NH4+、Cu2+、NO3-、SO42-c(OH-)c(H+)B.0.1mol?L-1的氨水:Cu2+、Na+、SO42-、NO3- C.1mol?L-1的NaClO溶液:Fe2+、Al3+、NO3-、I- D.0.1mol?L-1的NaHCO3溶液:K+、Na+、NO3-、OH- 組卷:54引用:5難度:0.6 -
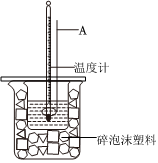 6.分別取40mL的0.50mol/L鹽酸與40mL的0.55mol/L氫氧化鈉溶液混合進行中和熱的測定,下列說法正確的是( )
6.分別取40mL的0.50mol/L鹽酸與40mL的0.55mol/L氫氧化鈉溶液混合進行中和熱的測定,下列說法正確的是( )A.若將鹽酸換成醋酸,則放出的熱量偏少 B.儀器A的名稱是玻璃棒 C.酸堿混合時,量筒中NaOH溶液應緩緩倒入小燒杯中,不斷用玻璃棒攪拌 D.用氫氧化鋇和硫酸代替氫氧化鈉和鹽酸溶液,結(jié)果也是正確的 組卷:27引用:2難度:0.5
二、非選擇題(58分)
-
17.實驗室中有一未知濃度的稀鹽酸,某學生為測定鹽酸的濃度在實驗室中進行如下實驗.
(1)配制100mL 0.10mol/L NaOH標準溶液.
(2)取20.00mL待測稀鹽酸溶液放入錐形瓶中,并滴加2~3滴酚酞作指示劑,用自己配制的標準NaOH溶液進行滴定.重復上述滴定操作2~3次,記錄數(shù)據(jù)如下.
請完成下列問題:實驗編號 NaOH溶液的濃度
(mol/L)滴定完成時,NaOH溶液滴入的體積(mL) 待測鹽酸溶液的體積
(mL)1 0.10 22.62 20.00 2 0.10 22.72 20.00 3 0.10 22.80 20.00
①滴定達到終點的現(xiàn)象是.
②根據(jù)上述數(shù)據(jù),可計算出該鹽酸的濃度約為(保留兩位有效數(shù)字)
③排去堿式滴定管中氣泡的方法應采用操作,然后輕輕擠壓玻璃球使尖嘴部分充滿堿液.
④在上述實驗中,下列操作(其他操作正確)會造成測定結(jié)果偏高的有.(多選扣分)
A、滴定終點讀數(shù)時俯視讀數(shù)
B、酸式滴定管使用前,水洗后未用待測鹽酸溶液潤洗
C、錐形瓶水洗后未干燥
D、稱量前NaOH固體中混有Na2CO3固體
E、配制好的NaOH標準溶液保存不當,部分與空氣中的CO2反應生成了Na2CO3
F、堿式滴定管尖嘴部分有氣泡,滴定后消失
G、滴定過程中,錐形瓶的振蕩過于激烈,使少量溶液濺出.組卷:39引用:10難度:0.5 -
 18.25℃時,三種酸的電離平衡常數(shù)如表所示。
18.25℃時,三種酸的電離平衡常數(shù)如表所示。
回答下列問題:化學式 CH3COOH HClO H3PO3 名稱 醋酸 次氯酸 亞磷酸 電離平衡常數(shù) 1.8×10-5 3.0×10-8 K1=8.3×10-3
K2=5.6×10-6
(1)濃度均為0.1mol/L的CH3COOH、HClO、H3PO3溶液中,c(H+)由大到小的排列是。
(2)亞磷酸(H3PO3)為二元酸,具有較強的還原性Na2HPO3是(填“酸式鹽”“堿式鹽”或“正鹽”)。此時亞磷酸的電離平衡常數(shù)表達式K=。
(3)常溫下,0.1mol/L的CH3COOH溶液加水稀釋的過程中,下列表達式的數(shù)值變大的是(填字母)。
A.c(H+)
B.c(H+)c(CH3COOH)
C.c(CH3COO-)
D.c(CH3COOH)
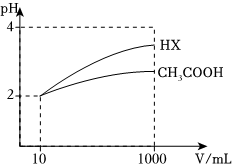
(4)體積為10mL、pH=2的醋酸溶液與一元酸HX分別加水稀釋至1000mL,稀釋過程pH變化如圖,則HX的電離平衡常數(shù)(填“大于”“小于”或“等于”,下同)醋酸的電離平衡常數(shù)。稀釋后,HX溶液中水電離出來的c(H+)醋酸溶液中水電離出來的c(H+)。組卷:7引用:2難度:0.7


