下列方法不能實現對應化學反應速率測定的是( )
| A | Fe2O3+3CO═2Fe+3CO2 | 壓力傳感器測量反應前后體系壓強變化 |
| B | Mg+2HCl═MgCl2+H2↑ | 分析天平稱量鎂條變化前后的質量變化 |
| C | 2H2O2 催化劑 |
注射器收集反應后氣體體積 |
| D | Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O | 濁度計測量反應前后濁度變化 |
【考點】測定某些化學反應的速率;化學反應速率的影響因素.
【答案】A
【解答】
【點評】
聲明:本試題解析著作權屬菁優(yōu)網所有,未經書面同意,不得復制發(fā)布。
發(fā)布:2024/5/27 14:0:0組卷:103引用:4難度:0.7
相似題
-
1.教材采用圖1實驗裝置測定鋅與稀硫酸反應的速率。
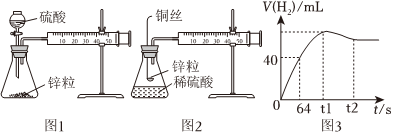
(1)檢查圖1裝置氣密性的操作方法是。
(2)分別取2g顆粒大小相同的鋅粒分別與體積均為40mL的1mol/L硫酸、4mol/L硫酸反應,收集25mL H2時所需時間后者比前者。
(3)同學們在實驗操作中發(fā)現,本實驗設計存在明顯不足,例如(舉兩例)。
(4)某化學興趣小組對教材實驗裝置進行圖2所示改進。檢查裝置氣密性后進行的實驗操作有:
a.在多孔塑料袋中裝入鋅粒;
b.在錐形瓶中加入40mL 1mol/L硫酸;
c.塞好橡膠塞,時立即用秒表計時;
d.注射器內每增加5mL氣體時讀取一次秒表。
(5)實驗觀察到鋅與稀硫酸反應初期速率逐漸加快,其原因是,反應進行一定時間后速率逐漸減慢,原因是。
(6)測得產生H2的體積與反應時間的關系曲線如圖3所示,t1~t2時間段氫氣體積略有減小的原因是;在64s內用H+濃度表示的平均反應速率v(H+)=(此時,溶液體積仍為40mL,氣體摩爾體積為25L/mol)。發(fā)布:2024/6/27 10:35:59組卷:231引用:2難度:0.1 -
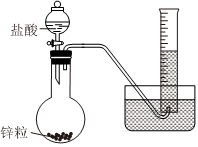 2.某學生設計下列裝置測定鋅粒與一定濃度的鹽酸反應的速率(用HCl的濃度變化表示平均反應速率),下列對該裝置的評價錯誤的是( )
2.某學生設計下列裝置測定鋅粒與一定濃度的鹽酸反應的速率(用HCl的濃度變化表示平均反應速率),下列對該裝置的評價錯誤的是( )A.實驗還需要計時器--秒表 B.加入的鹽酸會造成測定的反應速率偏大 C.測定數據為一定時間內量筒中氣體體積或量筒中收集一定體積氣體所需要的時間 D.鹽酸應慢慢滴加,以減小HCl揮發(fā)造成的實驗誤差 發(fā)布:2024/6/27 8:0:9組卷:16引用:3難度:0.8 -
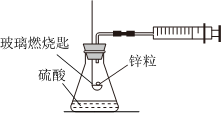 3.實驗室用圖裝置測定鋅與硫酸反應的速率,下列說法正確的是( )
3.實驗室用圖裝置測定鋅與硫酸反應的速率,下列說法正確的是( )A.實驗前可以不檢查裝置的氣密性 B.可用秒表判斷收集定體積氫氣的時間 C.若錐形瓶中再加入硫酸鈉溶液,測得的v(H2)不變 D.硫酸濃度越大,實驗效果越好,誤差越小 發(fā)布:2024/8/1 8:0:9組卷:11引用:1難度:0.7


