空氣是一種重要的自然資源。
(1)食物的腐敗主要與空氣中的O2O2氣體有關,為延長食品保質期,常常在食品包裝袋中充入空氣中含量最多的氣體,該氣體是N2N2(填化學式)。
(2)氦氣是一種稀有氣體,其化學式為HeHe,氦氣可用于填充探空氣球,這是利用它密度很小密度很小的性質。與用氫氣填充氣球相比,用氦氣填充氣球的優點是化學性質不活潑、不可燃、安全化學性質不活潑、不可燃、安全。
(3)如圖甲是三種測定空氣中氧氣含量的裝置圖:
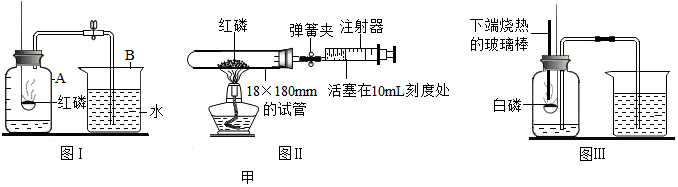
①圖I實驗中紅磷燃燒的現象是產生大量白煙產生大量白煙,反應的化學式表達式為4P+4O2 點燃 2P2O54P+4O2 點燃 2P2O5。
②圖II實驗中檢查裝置氣密性的方法是打開彈簧夾,將注射器活塞往外拉一段距離,松開手后注射器活塞回到原位說明不漏氣(合理即可)打開彈簧夾,將注射器活塞往外拉一段距離,松開手后注射器活塞回到原位說明不漏氣(合理即可),試管的中空氣的體積約為40毫升,燃燒紅磷時彈簧夾處于關閉狀態,等試管冷卻打開彈簧夾,理論上注射器活塞最終應停留在刻度22mL處。
③圖IⅡ實驗過程中集氣瓶中液面變化是先下降后上升先下降后上升,與圖I實驗相比較,該實驗具有的優點有ABCABC。
A.不需要將白磷在瓶外點燃再插入集氣瓶,可以使測定結果更準確
B.白磷燃燒時,集氣瓶中的水可以起到緩沖氣壓的作用
C.可以減少環境污染
(4)如圖乙是以空氣和其他必要的原料合成氮肥碳酸氫銨(NH4HCO3)的流程。請按要求回答下列問題:
①步驟I可以根據液態氮和液態氧的沸點沸點不同分離液態空氣獲得氮氣和氧氣,該過程屬于物理物理變化。
②寫出步驟②中發生反應的化學方程式3H2+N2 一定條件 2NH33H2+N2 一定條件 2NH3。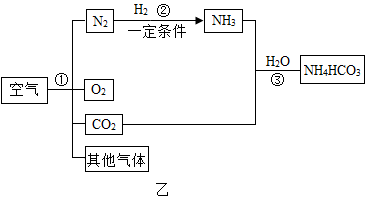
③據國家標準,碳酸氫銨化肥中純碳酸氫銨的含量不得低于95%.可用將碳酸氫銨化肥與堿溶液反應,將其中氮元素全部轉化為氨氣來測定化肥中氮元素的含量(化肥中其他成分不含氮)。取某碳酸氫銨化肥樣品8.0與足量堿溶液反應得到氨氣的質量如下表所示:
點燃
點燃
一定條件
一定條件
| 試驗次數 | 1 | 2 | 3 |
| 樣品質量(g) | 8.00 | 8.00 | 8.00 |
| 氨氣質量(g) | 1.71 | 1.69 | 1.70 |
氨氣的平均質量=(1.71g+1.69g+1.70g)÷3=1.70g
氨氣中氮元素的質量=1.70g×14/17=1.4g
碳酸氫銨的質量=1.4g÷14/79=7.9g
化肥中碳酸氫銨的質量分數=7.9g/8g×100%=98.75%>95%
達到國家標準
氨氣中氮元素的質量=1.70g×14/17=1.4g
碳酸氫銨的質量=1.4g÷14/79=7.9g
化肥中碳酸氫銨的質量分數=7.9g/8g×100%=98.75%>95%
達到國家標準
氨氣的平均質量=(1.71g+1.69g+1.70g)÷3=1.70g
氨氣中氮元素的質量=1.70g×14/17=1.4g
碳酸氫銨的質量=1.4g÷14/79=7.9g
化肥中碳酸氫銨的質量分數=7.9g/8g×100%=98.75%>95%
達到國家標準
。氨氣中氮元素的質量=1.70g×14/17=1.4g
碳酸氫銨的質量=1.4g÷14/79=7.9g
化肥中碳酸氫銨的質量分數=7.9g/8g×100%=98.75%>95%
達到國家標準
【考點】化肥的有關計算;空氣的成分及各成分的體積分數;測定氧氣含量過程中壓強變化引起的活塞位置變化問題;稀有氣體的用途;物質的相互轉化和制備;化合物中某元素的質量計算;書寫化學方程式、文字表達式、電離方程式.
【答案】O2;N2;He;密度很小;化學性質不活潑、不可燃、安全;產生大量白煙;4P+4O2 2P2O5;打開彈簧夾,將注射器活塞往外拉一段距離,松開手后注射器活塞回到原位說明不漏氣(合理即可);2;先下降后上升;ABC;沸點;物理;3H2+N2 2NH3;氨氣的平均質量=(1.71g+1.69g+1.70g)÷3=1.70g
氨氣中氮元素的質量=1.70g×14/17=1.4g
碳酸氫銨的質量=1.4g÷14/79=7.9g
化肥中碳酸氫銨的質量分數=7.9g/8g×100%=98.75%>95%
達到國家標準
點燃
一定條件
氨氣中氮元素的質量=1.70g×14/17=1.4g
碳酸氫銨的質量=1.4g÷14/79=7.9g
化肥中碳酸氫銨的質量分數=7.9g/8g×100%=98.75%>95%
達到國家標準
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:36引用:2難度:0.3
相似題
-
 1.某品牌碳酸氫銨化肥的標簽如圖所示,根據信息判斷下列說法正確的是( )
1.某品牌碳酸氫銨化肥的標簽如圖所示,根據信息判斷下列說法正確的是( )A.碳酸氫銨中各元素的質量分數由大到小的順序為O、C、H、N B.碳酸氫銨中氮、氫、氧、碳四種元素的質量比14:4:12:48 C.若含氮量完全正確,則該化肥中碳酸氫銨的含量為79% D.每袋該化肥中含氮量與30kg尿素【化學式為CO(NH2)2】含氮量相當 發布:2024/9/22 7:0:8組卷:113引用:4難度:0.8 -
2.王強家菜地里的蔬菜葉色發黃。周日,爸爸叫王強去買化肥硝酸銨,他趕到商場時,硝酸銨剛好賣完。
(1)根據所學的化學知識,你建議他購買(填序號),也能起到與硝酸銨相同的作用。
A.氯化鉀(KCl)
B.尿素[CO(NH2)2]
C.磷礦粉[Ca3(PO4)2]
(2)硝酸銨中氮元素的質量分數為。現菜地需施用硝酸銨8kg,若要達到同樣的施肥效果,則王強需購買(1)中所選的化肥kg。
(3)王強認為將硝酸銨和熟石灰混合施用,既可給農作物提供營養元素,又可降低土壤的酸性。你認為對不對?,原因是。發布:2024/7/31 8:0:9組卷:1引用:0難度:0.9 -
3.為測定某碳酸氫銨化肥樣品中的含氮量,某同學在實驗室里取用8.5g該化肥樣品與20gNaOH溶液放入燒杯中共熱,恰好完全反應,生成的氨氣全部逸出后,測得燒杯中殘留物為26.8g(反應的化學方程式為 NH4HCO3+2NaOH=Na2CO3+2H2O+NH3↑)。試求:
(1)生成氨氣的質量。
(2)該化肥中碳酸氫銨的質量。
(3)該化肥中氮元素的質量分數為(雜質中不含氮元素,計算結果精確到0.1%)。
(4)有同學認為用這種方法測得的氮元素質量分數會偏大,原因你認為是。發布:2024/11/24 8:0:2組卷:5引用:1難度:0.5


