為了探究化學反應(yīng)速率和化學反應(yīng)限度的有關(guān)問題,某研究小組進行了以下實驗:
Ⅰ.以H2O2的分解反應(yīng)為研究對象,實驗方案與數(shù)據(jù)記錄如表,t表示收集a mL O2所需的時間:
| 序號 | 反應(yīng) 溫度/℃ |
c(H2O2)/ mol?L-1 |
V(H2O2) /mL |
m(MnO2) /g |
t/min |
| 1 | 20 | 2 | 10 | 0 | t1 |
| 2 | 20 | 2 | 10 | 0.1 | t2 |
| 3 | 20 | 4 | 10 | 0.1 | t3 |
| 4 | 40 | 2 | 10 | 0.1 | t4 |
H2O2的濃度
H2O2的濃度
對化學反應(yīng)速率的影響;(2)為研究溫度對化學反應(yīng)速率的影響,可以將實驗
2
2
和實驗 4
4
作對比(填序號);(3)將實驗1和實驗2作對比,t1
>
>
t2(填“>”、“<”或“=”).Ⅱ.以KI和FeCl3反應(yīng)為例(2Fe3++2I-?2Fe2++I2)設(shè)計實驗,探究此反應(yīng)存在一定的限度.可選試劑:
①0.1mol?L-1KI溶液②0.1mol?L-1 FeCl3溶液③0.1mol?L-1 FeCl2溶液
④0.1mol?L-1鹽酸⑤0.1mol?L-1KSCN溶液⑥CCl4
實驗步驟:
(1)取5mL 0.1mol?L-1 KI溶液,再滴加幾滴0.1mol?L-1 FeCl3溶液;
(2)充分反應(yīng)后,將溶液分成三份;
(3)取其中一份,加試劑⑥,振蕩,CCl4層顯紫色,說明反應(yīng)生成碘;
(4)另取一份,加試劑
⑤
⑤
(填序號),溶液出現(xiàn)血紅色
溶液出現(xiàn)血紅色
現(xiàn)象,說明此反應(yīng)存在一定的限度.Ⅲ.N2O4可分解為NO2.在100mL密閉容器中投入0.01mol N2O4,利用現(xiàn)代化學實驗技術(shù)跟蹤測量c(NO2).c(NO2)隨時間變化的數(shù)據(jù)記錄如圖所示:

(1)反應(yīng)容器中最后剩余的物質(zhì)有
NO2、N2O4
NO2、N2O4
,其中N2O4的物質(zhì)的量為 0.004mol
0.004mol
mol;(2)c(NO2)隨時間變化的曲線表明,實驗測得的化學反應(yīng)速率在逐漸減小,最后
不變
不變
.(選填“變大”,“變小”或“不變”)【考點】探究影響化學反應(yīng)速率的因素.
【答案】H2O2的濃度;2;4;>;⑤;溶液出現(xiàn)血紅色;NO2、N2O4;0.004mol;不變
【解答】
【點評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/8/17 5:0:1組卷:18引用:2難度:0.3
相似題
-
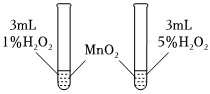 1.控制變量法是化學實驗的常用方法之一,如圖所示實驗探究影響反應(yīng)速率的因素是( )
1.控制變量法是化學實驗的常用方法之一,如圖所示實驗探究影響反應(yīng)速率的因素是( )A.催化劑 B.溫度 C.濃度 D.壓強 發(fā)布:2024/12/30 14:0:1組卷:44引用:3難度:0.6 -
2.為探究影響化學反應(yīng)速率的因素,某研究小組設(shè)計了如下五個實驗。按要求回答下列問題(已知:Cu2+、Fe3+對H2O2的分解起催化作用)。
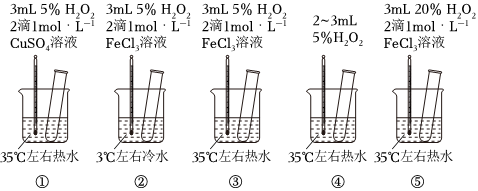
(1)為探究溫度對化學反應(yīng)速率的影響,應(yīng)選擇實驗(填序號,下同),選擇的依據(jù)是。
(2)為探究催化劑對化學反應(yīng)速率的影響,同時探究催化劑不同催化效果不同,應(yīng)選擇實驗。
(3)通過觀察發(fā)現(xiàn)實驗⑤比實驗③現(xiàn)象明顯,其原因是。
(4)根據(jù)上述實驗,用H2O2快速制取少量O2,可采取的三條措施為。發(fā)布:2024/12/30 14:30:1組卷:8引用:5難度:0.5 -
 3.(一)Fenton法常用于處理含有難降解有機物的工業(yè)廢水,通常是在調(diào)節(jié)好pH和Fe2+濃度的廢水中加入H2O2,所產(chǎn)生的羥基自由基能氧化降解污染物.現(xiàn)運用該方法降解有機污染物p-CP,探究有關(guān)因素對該降解反應(yīng)速率的影響.實驗中控制p-CP的初始濃度相同,恒定實驗溫度在298K或313K下設(shè)計如下對比實驗(其余實驗條件見下表):
3.(一)Fenton法常用于處理含有難降解有機物的工業(yè)廢水,通常是在調(diào)節(jié)好pH和Fe2+濃度的廢水中加入H2O2,所產(chǎn)生的羥基自由基能氧化降解污染物.現(xiàn)運用該方法降解有機污染物p-CP,探究有關(guān)因素對該降解反應(yīng)速率的影響.實驗中控制p-CP的初始濃度相同,恒定實驗溫度在298K或313K下設(shè)計如下對比實驗(其余實驗條件見下表):
(1)編號③的實驗?zāi)康氖?!--BA-->實驗序號 實驗?zāi)康?/td> T/K pH c/10-3mol?L-1 H2O2 Fe2+ ① 為以下實驗作參照物 298 3 6.0 0.30 ② 探究溫度對降解反應(yīng)速率的影響 313 3 6.0 0.30 ③ 298 10 6.0 0.30 .
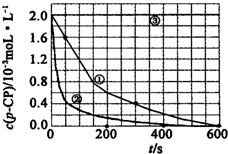
(2)實驗測得不同實驗編號中p-CP的濃度隨時間變化的關(guān)系如圖所示.請根據(jù)實驗①曲線,計算降解反應(yīng)在50-300s內(nèi)的平均反應(yīng)速率v(p-CP)=.
(3)實驗①②表明,溫度與該降解反應(yīng)速率的關(guān)系是.
(二)已知Fe3+和I-在水溶液中的反應(yīng)為2I-+2Fe3+=2Fe2++I2.正向反應(yīng)速率和I-、Fe3+的濃度關(guān)系為v=kcm(I-)cn(Fe3+)(k為常數(shù))
(4)請分析下表提供的數(shù)據(jù)回答以下問題:
①在v=kcm(I-)cn(Fe3+)中,m、n的值為c(I-)/(mol?L-1) c(Fe3+)/(mol?L-1) v/(mol?L-1?s-1) (1) 0.20 0.80 0.032k (2) 0.60 0.40 0.144k (3) 0.80 0.20 0.128k .(選填A(yù)、B、C、D)
A.m=1,n=1 B.m=1,n=2 C.m=2,n=1 D.m=2,n=2
②I-濃度對反應(yīng)速率的影響Fe3+濃度對反應(yīng)速率的影響(填“<”、“>”或“=”).
(三)一定溫度下,反應(yīng)FeO(s)+CO(g)?Fe(s)+CO2(g)的化學平衡常數(shù)為3.0,該溫度下將2mol FeO、4mol CO、5mol Fe、6mol CO2加入容積為2L的密閉容器中反應(yīng).請通過計算回答:
(5)v(正)v(逆)(填“>”、“<”或“=”);若將5mol FeO、4mol CO加入同樣的容器中,在相同溫度下達到平衡,則CO的平衡轉(zhuǎn)化率為.發(fā)布:2024/12/30 14:30:1組卷:19引用:2難度:0.5


