魯科版(2019)選擇性必修1《2.3 化學反應的速率》2023年同步練習卷(10)
發布:2024/8/17 5:0:1
一、選擇題
-
1.已知:4NH3+5O2═4NO+6H2O,若反應速率分別用v(NH3)、v(O2)、v(NO)、v(H2O)表示,則下列關系正確的是( )
A.4v(NH3)=5v(O2) B.5v(O2)=6v(H2O) C.3v(NH3)=2v(H2O) D.5v(O2)=4v(NO) 組卷:443引用:20難度:0.9 -
2.在溫度不變、恒容的容器中進行反應H2?2H△H>0,若反應物的濃度由0.1mol?L-1降到0.06mol?L-1需20s,那么由0.06mol?L-1降到0.036mol?L-1,所需反應時間應( )
A.等于10 s B.等于12 s C.大于12 s D.小于12 s 組卷:109引用:12難度:0.9 -
3.100mL 2mol/L的鹽酸與過量的鋅片反應時,為減慢反應速率,又不影響生成的氫氣的總量,可采用的方法是( )
A.加入適量的6 mol/L的鹽酸 B.加入適量的醋酸鈉固體 C.加入適量的NaOH固體 D.加入適量碳酸鈉溶液 組卷:84引用:3難度:0.7 -
4.反應 C(s)+H2O(g)?CO(g)+H2(g)在一可變容積的密閉容器中進行,下列條件的改變對其反應速率幾乎無影響的是( )
①增加C的量
②將容器的體積縮小一半
③保持體積不變,充入N2使體系壓強增大
④保持壓強不變,充入N2使容器體積變大A.①④ B.①③ C.②③ D.②④ 組卷:61引用:3難度:0.6 -
5.不同條件下,用O2氧化amol/L FeCl2溶液過程中所測的實驗數據如圖所示。下列分析或推測合理的是( )
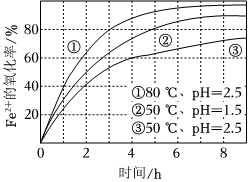
A.由①、②可知,pH越大,+2價鐵越易被氧化 B.由②、③推測,若pH>7,+2價鐵更難被氧化 C.由①、③推測,FeCl2被O2氧化的反應為放熱反應 D.60℃、pH=2.5時,4h內Fe2+的平均消耗速率大于 0.15a mol/(L?h) 組卷:110引用:10難度:0.7
四、實驗題
-
14.為了探究化學反應速率和化學反應限度的有關問題,某研究小組進行了以下實驗:
Ⅰ.以H2O2的分解反應為研究對象,實驗方案與數據記錄如表,t表示收集a mL O2所需的時間:
(1)設計實驗2和實驗3的目的是研究序號 反應
溫度/℃c(H2O2)/
mol?L-1V(H2O2)
/mLm(MnO2)
/gt/min 1 20 2 10 0 t1 2 20 2 10 0.1 t2 3 20 4 10 0.1 t3 4 40 2 10 0.1 t4 對化學反應速率的影響;
(2)為研究溫度對化學反應速率的影響,可以將實驗和實驗作對比(填序號);
(3)將實驗1和實驗2作對比,t1t2(填“>”、“<”或“=”).
Ⅱ.以KI和FeCl3反應為例(2Fe3++2I-?2Fe2++I2)設計實驗,探究此反應存在一定的限度.可選試劑:
①0.1mol?L-1KI溶液②0.1mol?L-1 FeCl3溶液③0.1mol?L-1 FeCl2溶液
④0.1mol?L-1鹽酸⑤0.1mol?L-1KSCN溶液⑥CCl4
實驗步驟:
(1)取5mL 0.1mol?L-1 KI溶液,再滴加幾滴0.1mol?L-1 FeCl3溶液;
(2)充分反應后,將溶液分成三份;
(3)取其中一份,加試劑⑥,振蕩,CCl4層顯紫色,說明反應生成碘;
(4)另取一份,加試劑(填序號),現象,說明此反應存在一定的限度.
Ⅲ.N2O4可分解為NO2.在100mL密閉容器中投入0.01mol N2O4,利用現代化學實驗技術跟蹤測量c(NO2).c(NO2)隨時間變化的數據記錄如圖所示: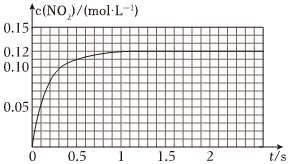
(1)反應容器中最后剩余的物質有,其中N2O4的物質的量為mol;
(2)c(NO2)隨時間變化的曲線表明,實驗測得的化學反應速率在逐漸減小,最后.(選填“變大”,“變小”或“不變”)組卷:18引用:2難度:0.3
五、解答題
-
 15.氮的氧化物是造成大氣污染主要物質,研究氮氧化物間的相互轉化及脫除對緩解環境污染具有重要意義。
15.氮的氧化物是造成大氣污染主要物質,研究氮氧化物間的相互轉化及脫除對緩解環境污染具有重要意義。
(1)CO還原NO的脫硝反應:2CO(g)+2NO(g)?2CO2(g)+N2(g)△H
已知:CO(g)+NO2(g)?CO2(g)+NO(g)△H1=-226kJ?mol-1
N2(g)+2O2(g)?2NO2(g)△H2=+68kJ?mol-1
N2(g)+O2(g)?2NO(g)△H3=+183kJ?mol-1
脫硝反應△H=,有利于提高NO平衡轉化率的條件是、。(寫出兩條)
(2)已知2NO(g)+O2(g)?2NO2(g)的反應歷程分兩步:
第一步2NO(g)?N2O2(g)(快反應);
第二步N2O2(g)+O2(g)?2NO2(g)(慢反應)
下列關于反應2NO(g)+O2(g)?2NO2(g)的說法正確的是。(填序號)
A.壓縮體積增大壓強,正逆反應速率均一定增大
B.第一步反應的活化能小于第二步反應的活化能
C.第一步反應的速率決定總反應速率快慢
(3)某溫度下,向體積為2L的恒容容器中通入2.00mol NO2,發生反應:2NO2(g)?N2O4(g)△H=57.0kJ?mol-1,已知:v正(NO2)=k1?c2(NO2),v逆(N2O4)=k2?c(N2O4),其中k1、k2為速率常數測得NO2的體積分數[α(NO2)]與反應時間(t)的關系如表。
則①平衡時,c(N2O4)=t/min 0 20 40 60 80 α(NO2) 1.0 0.75 0.52 0.50 0.50 。(計算結果保留兩位小數)
②的數值為K1K2。
(4)以NH3為還原劑在脫硝裝置中消除煙氣中的氮氧化物。
主反應:4NH3(g)+4NO(g)═4N2(g)+6H2O(g)△H1=-1626.9kJ/mol-1
副反應:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H2=-907.3kJ/mol-1
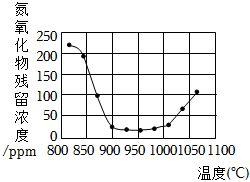
將煙氣按一定的流速通過脫硝裝置,測得出口NO的濃度與溫度的關系如圖,試分析脫硝的適宜溫度是(填序號)。溫度超過1000℃,NO濃度升高的原因是。
A.<850℃
B.900~1000℃
C.>1050℃組卷:33引用:2難度:0.5


