以下是關于“外界因素對化學平衡移動影響的實驗研究”的課題,回答問題:
(1)研究的思路與方法.
①研究對象的選擇,現有以下可逆反應:
A.2NO2(g)?N2O4(g)△H<0
B.FeCl3+3KSCN?Fe(SCN)3+3KCl
其中,A適合于研究abcabc對平衡的影響,B適合于研究abab對平衡的影響.(填字母:a.濃度、b.溫度、c.壓強)
②研究方法:采用控制其他因素不變,改變其中一個因素的方法,并進行對比實驗.
(2)單一因素對化學平衡移動影響的實驗研究.
①濃度:將FeCl3與KSCN反應后所得的混合液分為三等份,分別加入濃FeCl3溶液、濃KSCN溶液和NaOH固體,觀察現象.
現象:加入濃FeCl3溶液后的混合溶液紅色變深變深;加入濃KSCN溶液后的混合溶液紅色變深變深;加入NaOH固體后,混合溶液紅色變淺變淺.
②溫度:將密封并相互連通的盛有NO2的兩個玻璃球,一個放入熱水中,另一個放入冷水中.
現象:放入熱水中的球內紅棕色變深變深;放入冷水中的球內紅棕色變淺變淺.
(3)綜合(2)中研究結果,請總結外界因素對化學平衡的影響規律在其它條件不變時,增大反應物濃度,平衡向正反應方向移動;升高溫度,平衡向吸熱反應方向移動,降低溫度,平衡向放熱方向移動在其它條件不變時,增大反應物濃度,平衡向正反應方向移動;升高溫度,平衡向吸熱反應方向移動,降低溫度,平衡向放熱方向移動.
【考點】探究溫度、壓強對化學平衡的影響.
【答案】abc;ab;變深;變深;變淺;變深;變淺;在其它條件不變時,增大反應物濃度,平衡向正反應方向移動;升高溫度,平衡向吸熱反應方向移動,降低溫度,平衡向放熱方向移動
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:254引用:4難度:0.3
相似題
-
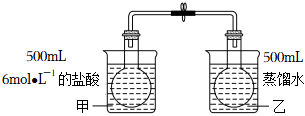 1.已知反應:2NO2(g)?N2O4(g),△H<0,為了探究溫度對化學平衡的影響,有人做了如圖實驗:把NO2和N2O4的混合氣體通入甲、乙兩個連通的燒瓶里,然后用夾子夾住橡皮管,把兩燒瓶分別浸入兩個分別盛有500mL 6mol/L的HCl溶液和盛有500mL蒸餾水的燒杯中(兩燒杯中溶液的溫度相同).
1.已知反應:2NO2(g)?N2O4(g),△H<0,為了探究溫度對化學平衡的影響,有人做了如圖實驗:把NO2和N2O4的混合氣體通入甲、乙兩個連通的燒瓶里,然后用夾子夾住橡皮管,把兩燒瓶分別浸入兩個分別盛有500mL 6mol/L的HCl溶液和盛有500mL蒸餾水的燒杯中(兩燒杯中溶液的溫度相同).
(1)該實驗用兩個經導管連通的燒瓶,其設計意圖是.
(2)向燒杯甲的溶液中放入125g NaOH固體,同時向燒杯乙中放入125g硝酸銨晶體,攪拌使之溶解.甲燒瓶內氣體的顏色將,原因是;乙燒瓶內氣體的顏色將,原因是.
(3)該實驗欲得出的結論是.
(4)某同學認為該實驗的設計并不完全科學,他指出此時影響化學平衡的因素不止一個,你認為他所指的另一個因素是.發布:2024/5/23 20:38:36組卷:119引用:3難度:0.3 -
2.在3種不同條件下,分別向容積為2L的恒容密閉容器中充入2molA和1molB,發生反應:2A(g)+B(g)?2C(g)△H=QkJ?mol-1.相關條件和數據見表:
下列說法正確的是( )實驗編號 實驗Ⅰ 實驗Ⅱ 實驗Ⅲ 反應溫度/℃ 700 700 750 達平衡時間/min 40 5 30 平衡時n(C)/mol 1.5 1.5 1 化學平衡常數 K1 K2 K3 A.K1=K2<K3 B.升高溫度能加快反應速率的原因是降低了反應的活化能 C.實驗Ⅱ比實驗Ⅰ達平衡所需時間小的可能原因是使用了催化劑 D.實驗Ⅲ達平衡后,恒溫下再向容器中通入1molA和1molC,平衡正向移動 發布:2024/4/20 14:35:0組卷:478引用:10難度:0.5 -
3.高溫下,某反應達到平衡,平衡常數K=
恒容時,溫度升高,H2濃度減小。下列說法正確的是( )c(CO)?c(H2O)c(CO2)?c(H2)A.該反應的焓變為正值 B.恒溫恒容下,增大壓強,H2濃度一定減小 C.升高溫度,正反應速率增大,逆反應速率減小 D.該反應的化學方程式為CO+H2O?CO2+H2 發布:2024/5/23 20:38:36組卷:410引用:3難度:0.8


