研究人員利用含硫物質熱化學循環實現太陽能的轉化與存儲,過程如下:
(1)反應Ⅰ:2H2SO4 (l)═2SO2(g)+2H2O(g)+O2(g)△H1=+551kJ?mol-1
反應Ⅲ:S(s)+O2(g)═SO2(g)△H3=-297kJ?mol-1
反應Ⅱ的熱化學方程式3SO2(g)+2H2O(g)=2H2SO4(l)+S(s)△H=-254kJ/mol3SO2(g)+2H2O(g)=2H2SO4(l)+S(s)△H=-254kJ/mol。
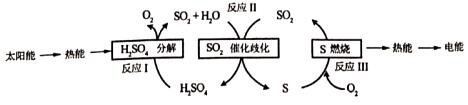
(2)對于反應Ⅱ,在投料比【n(SO2):n(H2O)】為3:2時,兩種壓強下,H2SO4在平衡體系中物質的量分數隨溫度的變化關系如圖1所示。
①下列說法不正確的是CDCD。
A.p2>pl
B.反應Ⅱ的△s<0
C.使用合適催化劑可以提高H2SO4在平衡體系中物質的量分數
D.其他條件相同時,投料比【n(SO2):n(H2O)】改變為2:1,可提高SO2的平衡轉化率
②對于反應Ⅱ,在某一投料比時,分別為140℃和180℃下,在圖2中畫出H2SO4在平衡體系中物質的量分數隨壓強的變化關系示意圖。
(3)I-可以作為水溶液中SO2歧化反應的催化劑,可能的催化過程如下:
i.SO2+4I-+4H+═S↓+2I2+2H2O
ⅱ.I2+2H2O+SO2═SO42-+4H++2I-
為探究i、ⅱ反應速率與SO2歧化反應速率的關系,實驗如下:分別將18mL SO2飽和溶液加入到2mL下列試劑中,密閉放置觀察現象。(已知:I2易溶解在KI溶液中)
| 序號 | A | B | C | D |
| 試劑組成 | 0.4mol?L-1 KI | 0.4mol?L-1 KI 0.2mol?L-1 H2SO4 |
0.2mol?L-1 H2SO4 | 0.2mol?L-1 KI 0.0002 mol I2 |
| 實驗現象 | 溶液變黃,一段時間后出現渾濁 | 溶液變黃,出現渾濁較A快 | 無明顯現象 | 溶液由棕褐色很快褪色,變成黃色,出現渾濁較A快 |
I-為SO2歧化反應的催化劑,氫離子單獨存在時不具有催化作用,但氫離子可加快歧化反應速率
I-為SO2歧化反應的催化劑,氫離子單獨存在時不具有催化作用,但氫離子可加快歧化反應速率
。②實驗表明,SO2的歧化反應速率D>A,結合i、ⅱ反應速率解釋原因
反應ⅱ比反應i快,D中由反應ii產生的氫離子使反應i加快
反應ⅱ比反應i快,D中由反應ii產生的氫離子使反應i加快
。【答案】3SO2(g)+2H2O(g)=2H2SO4(l)+S(s)△H=-254kJ/mol;CD;I-為SO2歧化反應的催化劑,氫離子單獨存在時不具有催化作用,但氫離子可加快歧化反應速率;反應ⅱ比反應i快,D中由反應ii產生的氫離子使反應i加快
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/8/17 8:0:1組卷:82引用:4難度:0.5
相似題
-
1.升高溫度,下列數據不一定增大的是( )
A.化學反應速率v B.水的離子積常數Kw C.化學平衡常數K D.氨水的電離平衡常數Ka 發布:2025/1/6 6:0:5組卷:31引用:4難度:0.7 -
2.催化還原CO2是解決溫室效應及能源問題的重要手段之一。研究表明,在Cu/ZnO催化劑存在下,CO2和H2可發生以下兩個平衡反應。下列有關說法不正確的是( )
①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-53.7kJ?mol-1
②CO2(g)+H2(g)?CO(g)+H2O(g)△H2=+41.2kJ?mol-1A.反應①為放熱反應,反應②為吸熱反應 B.使用不同催化劑,會改變反應①②的△H C.反應CO(g)+2H2(g)?CH3OH(g)的△H3=-94.9kJ?mol-1 D.投料比不變,增加反應物的濃度可提高CO2轉化為CH3OH平衡轉化率 發布:2025/1/6 6:0:5組卷:90引用:3難度:0.5 -
3.現代工業將煤汽化,既可以提高燃料的利用率、減少CO、SO2等的排放,又可以擴大水煤氣的用途.甲醇是一種可再生能源,具有開發和應用的廣闊前景,工業上一般可采用水煤氣來合成甲醇CO(g)+2H2(g)?CH3OH(g).
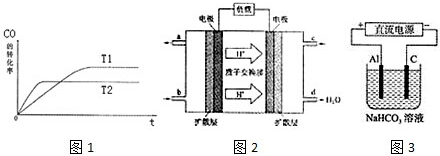
(1)如圖1是該反應在不同溫度下CO的轉化率隨時間變化的曲線.
①T1和T2溫度下的平衡常數大小關系是K1K2(填“>”、“<”或“=”).
②以下有關說法正確的是
a.恒溫、恒容條件下,容器內的壓強不發生變化則可逆反應達到平衡
b.一定條件下,H2的消耗速率是CO的消耗速率的2倍時可逆反應達到平衡
c.使用合適的催化劑能縮短達到平衡的時間并提高CH3OH的產率
d.某溫度下,將2molCO和6molH2充入2L的密閉容器中,充分反應,達到平衡后,測得c(CO)=0.2mol/L,則CO的轉化率為80%
(2)已知在常溫常壓下①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g)△H=-akJ?mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-bkJ?mol-1③H2O(g)=H2O(1)△H=-ckJ?mol-1
則:CH3OH(1)+O2(g)=CO(g)+2H2O(1)△H=kJ?mol-1
(3)2009年10月,中國科學院長春應用化學研究所在甲醇燃料電池技術方面獲得新突破,組裝出了自呼吸電池及主動式電堆.甲醇燃料電池的工作原理如圖2所示.
①該電池正極的電極反應式為.
②工作一段時間后,當6.4g甲醇完全反應生成CO2時,有個電子發生轉移.
(4)以上述電池做電源,用圖3所示裝置,在實驗室中模擬鋁制品面“鈍化”處理的過程中,發現溶液逐漸變渾濁,原因是、(用相關的電極反應式和離子方程式表示)發布:2024/12/30 14:0:1組卷:26引用:3難度:0.5


