“汽泡爽”是一種沖調飲料。其主要原料為檸檬酸(C6H8O7)和小蘇打(NaHCO3);使用時將一包汽泡爽粉末倒入玻璃杯中,加入200mL冷水,看到有大量氣泡快速生成,待粉末完全溶解,就得到一杯果味飲料。
【活動一】探究“汽泡爽”產生氣體的成分
(1)小雪閱讀資料發現:“汽泡爽”原料中的檸檬酸(C6H8O7)和小蘇打(NaHCO3)粉末混合后加水,可以發生以下反應:3NaHCO3+C6H8O7=C6H5O7Na3+3H2O+3R↑,則R的化學式為 CO2CO2;實驗室通常用 澄清石灰水澄清石灰水檢驗R氣體,其發生反應的化學方程式為 CO2+Ca(OH)2=CaCO3↓+H2OCO2+Ca(OH)2=CaCO3↓+H2O。
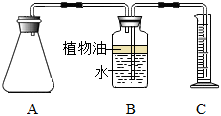
【活動二】探究加水溫度對產生氣體量的影響
(2)小雪先用冷水和熱水各沖了一杯飲料,品嘗時發現冷水沖的飲料中氣泡較多,熱水沖的飲料中氣泡較少。當她搖動杯子時,發現冷水沖的飲料中又有大量氣泡從水中逸出。于是,小雪總結出:隨著溫度升高,氣體在一定量的水中溶解的量會迅速 減小減小。隨后又設計了如下實驗方案對以上觀點進行證明。
| 實驗序號 | 加入水的體積 | 加入水的溫度 | 收集到氣體的體積 |
| ① | 200mL | 15℃ | a(待記錄) |
| ② | 200mL | 60℃ | b(待記錄) |
防止二氧化碳溶于水中
防止二氧化碳溶于水中
。
(4)通過實驗,小雪測得:a=64mL,b=132mL,由此獲得結論:“汽泡爽”產生氣體的量與加水溫度有關系。但是老師看到實驗報告后指出:兩套裝置中“汽泡爽”產生氣體的總量應該近似相等,與溫度關系不大,其本質原因是
反應遵守質量守恒定律
反應遵守質量守恒定律
。(5)為了證明老師的觀點,小雪決定繼續利用(3)中已反應完的兩套裝置又做了一次新設計的實驗,發現兩套裝置最終收集到的氣體總量確實相近,她的實驗操作應該是
搖動A裝置,并繼續收集產生的氣體
搖動A裝置,并繼續收集產生的氣體
。【答案】CO2;澄清石灰水;CO2+Ca(OH)2=CaCO3↓+H2O;減小;防止二氧化碳溶于水中;反應遵守質量守恒定律;搖動A裝置,并繼續收集產生的氣體
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:6引用:1難度:0.6
相似題
-
1.如圖1為實驗室常用的制取氣體的實驗裝置。
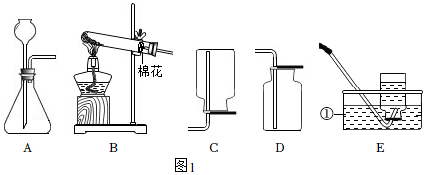
(1)寫出標有序號的儀器名稱:①。
(2)用裝置B和E組合制取氧氣,反應方程式為,若實驗結束時先熄滅酒精燈,再移出導氣管,導致的后果為。
(3)實驗室用稀硫酸和鋅粒制取氫氣的反應方程式為,用A裝置做發生裝置,檢查裝置氣密性時用止水夾夾緊導管,向長頸漏斗中加入水,若出現現象,則氣密性良好。
(4)實驗室用未知濃度的鹽酸和大理石制取二氧化碳,反應方程式為。同學們將制得的氣體通入澄清石灰水,未變渾濁。猜想可能的原因是:
①澄清石灰水已變質;
②氣體中除了有CO2外,還有氯化氫氣體。
經過討論設計如圖2裝置進行探究。試管I、試管Ⅱ盛放AgNO3溶液,試管Ⅲ中盛放原瓶中的澄清石灰水。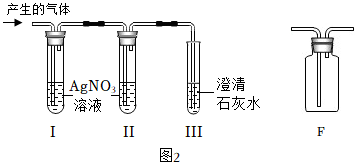
實驗過程:
根據試管I中的現象,試管Ⅱ中硝酸銀溶液未變渾濁,試管Ⅲ中的現象,同學們得出猜想①②兩個原因均存在的結論。
問題討論:
①試管Ⅱ中AgNO3溶液的作用為。
②同學們用F裝置除去CO2中的氯化氫氣體,F裝置中的藥品可選用(填序號)。
A.NaOH溶液
B.AgNO3溶液
C.飽和NaHCO3溶液發布:2024/12/24 8:0:11組卷:76引用:3難度:0.6 -
2.實驗小組研究幾種常用胃藥的抗酸效果。
【查閱資料】
i.溶液的pH越大,酸性越弱。人體胃液的主要成分為鹽酸,正常pH范圍為0.9~1.5。
ⅱ.三種胃藥的有效成分如下。胃藥使用不當,可能導致胃脹氣等癥狀。
【進行實驗】胃藥a 胃藥b 胃藥c 碳酸氫鈉
NaHCO3鋁碳酸鎂
Al2Mg6(OH)16CO3?4H2O氫氧化鋁
Al(OH)3
實驗一:驗證胃藥是否能抗酸
各取25mLpH=1.20的稀鹽酸放入三個小燒杯中,分別加入有效成分質量相同的三種胃藥,攪拌120s,觀察實驗現象并用pH傳感器測定反應后溶液的pH。
(1)胃藥a和胃藥b產生的氣體均為CO2,實驗室檢驗該氣體的試劑是現象 反應后溶液的pH 胃藥a 產生大量氣體 6.37 胃藥b 產生極少量氣體 4.25 胃藥c 無氣體 1.34 。
(2)胃藥c中的氫氧化鋁與鹽酸發生中和反應,其化學方程式為。
(3)由實驗一可知三種胃藥都能抗酸,依據是。
實驗二:探究影響胃藥抗酸效果的因素
下表所示實驗中,均取25mLpH=1.20的稀鹽酸,加入胃藥,攪拌,用pH傳感器測定一定反應時間后溶液的pH(反應后pH越大,抗酸效果越好)。
(4)探究反應時間對胃藥抗酸效果的影響的實驗組合是實驗編號 胃藥種類 有效成分質量/g 反應時間/s 溶液的pH ① 胃藥a 0.5 60 6.02 ② 胃藥a 0.5 120 6.37 ③ 胃藥a 0.5 180 6.54 ④ 胃藥b 0.5 60 3.93 ⑤ 胃藥b 0.5 120 4.25 ⑥ 胃藥b 0.5 180 4.70 ⑦ 胃藥c 0.5 60 1.26 ⑧ 胃藥c 0.5 120 1.34 ⑨ 胃藥c 0.5 180 1.42 (填序號,任寫一個組合)。
(5)由實驗二可知,胃藥種類對抗酸效果的影響的結論是。
【反思與評價】
(6)實際應用中,胃藥b比胃藥a、c使用得更多。結合上述實驗,說明胃藥b具有的優勢是。發布:2024/12/25 13:0:1組卷:177引用:2難度:0.5 -
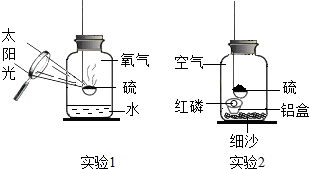 3.壽春中學化學組的同學設計了硫在氧氣中燃燒的改良實驗,如實驗1.當火焰熄滅后發現留有剩余,硫為什么會熄滅呢?每個人都提出了自己的猜想.
3.壽春中學化學組的同學設計了硫在氧氣中燃燒的改良實驗,如實驗1.當火焰熄滅后發現留有剩余,硫為什么會熄滅呢?每個人都提出了自己的猜想.
【猜想】
甲同學猜想:硫燃燒耗盡了瓶內的氧氣,所以它熄滅了;
乙同學猜想:硫燃燒后瓶內的二氧化硫(不支持硫的燃燒)濃度過高導致硫熄滅了;
丙同學猜想:甲和乙都只看到了問題的一個方面,他認為甲和乙都有道理;
丁同學猜想:.
【設計實驗】丁同學設計了實驗2進行實驗驗證自己的猜想:
【實驗反思】(1)硫燃燒的化學方程式為實驗步驟 實驗現象 實驗分析 實驗結論 (1)把少量紅磷放在鋁制小盒內,然后放入裝有細沙的集氣瓶,塞緊瓶塞,用放大鏡點燃硫,觀察現象. 硫燃燒一會兒就熄滅了. 磷燃燒需滿足的條件:①溫度達到著火點;
②丁同學的猜想正確. (2)待冷卻后,用放大鏡聚光加熱鋁盒內的紅磷,觀察現象. 紅磷燃燒,放出熱量的同時產生了 ;實驗2中硫燃燒的火焰顏色是色.
(2)實驗1與課本實驗相比,實驗1的優點是;
(3)實驗2中細沙的作用是.
(4)實驗室中測定空氣中氧氣體積分數實驗不用硫代替紅磷的原因是.發布:2024/12/2 8:0:1組卷:31引用:1難度:0.5


