軟錳礦的主要成分為MnO2,還含有Fe2O3、MgO、Al2O3、CaO、SiO2等雜質,工業上用軟錳礦制取MnSO4?H2O的流程如圖。
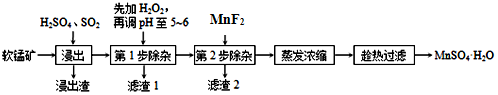
(1)“浸出”時所加的X酸是H2SO4H2SO4(填化學式),浸出渣的主要成分為SiO2SiO2(填化學式)。為了提高浸出速率,可采取哪些措施粉碎礦石粉碎礦石、進行攪拌進行攪拌?(回答兩點)。
(2)浸出過程中MnO2轉化為Mn2+的離子方程式為MnO2+SO2=Mn2++SO42-MnO2+SO2=Mn2++SO42-。
(3)第1步除雜,加過氧化氫的作用是將亞鐵離子氧化成鐵離子將亞鐵離子氧化成鐵離子,該反應的離子反應方程式為H2O2+2Fe2++2H+═2Fe3++2H2OH2O2+2Fe2++2H+═2Fe3++2H2O。第2步除雜,主要將Ca2+、Mg2+轉化為相應氟化物沉淀除去,寫出MnF2除去Mg2+的離子反應方程式:MnF2+Mg2+=MgF2MnF2+Mg2+=MgF2。(已知:MnF2的Ksp=5.6×10-3;MgF2的Ksp=8.0×10-11)。該反應的平衡常數K=7×1077×107。
(4)取少量MnSO4?H2O溶于水,配成溶液,測其pH發現該溶液顯酸性,原因是Mn2++2H2O=Mn(OH)2+2H+Mn2++2H2O=Mn(OH)2+2H+。(用離子方程式表示)
【考點】物質分離和提純的方法和基本操作綜合應用.
【答案】H2SO4;SiO2;粉碎礦石;進行攪拌;MnO2+SO2=Mn2++SO42-;將亞鐵離子氧化成鐵離子;H2O2+2Fe2++2H+═2Fe3++2H2O;MnF2+Mg2+=MgF2;7×107;Mn2++2H2O=Mn(OH)2+2H+
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:11引用:1難度:0.5
相似題
-
1.硫鐵礦燒渣是硫鐵礦生產硫酸過程中產生的工業廢渣(主要含Fe2O3及少量SiO2、Al2O3等雜質)。用該燒渣制取藥用輔料-紅氧化鐵的工藝流程如圖:
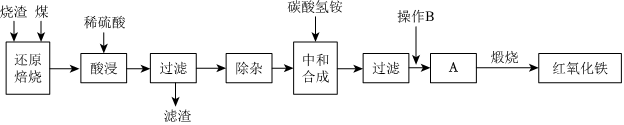
(1)在“還原焙燒”中產生的有毒氣體可能有。
(2)“酸浸”時間一般不超過20min,若在空氣中酸浸時間過長,溶液中Fe2+含量將下降,其原因是(用離子方程式表示)。
(3)“中和合成”的目的是將溶液中Fe2+轉變為碳酸亞鐵沉淀,則操作B是。
(4)煅燒A的反應方程式是。
(5)ag燒渣經過上述工藝可得紅氧化鐵bg。藥典標準規定,制得的紅氧化鐵中含氧化鐵不得少于98.0%,則所選用的燒渣中鐵的質量分數應不低于(用含a、b的表達式表示)。發布:2025/1/19 8:0:1組卷:30引用:1難度:0.5 -
2.我國青藏高原的鹽湖中蘊藏著豐富的鋰資源,已探明的儲量約三千萬噸,碳酸鋰制備高純金屬鋰的一種工藝流程如圖。下列有關說法錯誤的是( )
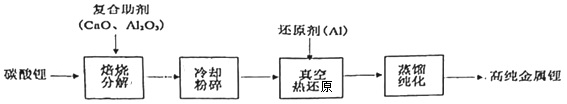
A.金屬鋰可保存在煤油中 B.使用復合助劑有利于碳酸鋰的分解 C.“粉碎”是為了增加接觸面積,加快反應速率 D.真空熱還原發生的主要化學反應為2Al+3Li2O 6Li+Al2O3高溫發布:2025/1/6 7:30:5組卷:28引用:2難度:0.9 -
3.查閱資料:CaO、MgO在高溫下與C難反應,但能與SiO2反應.硫鐵礦燒渣是一種工業廢渣(含Fe2O3及少量SiO2、Al2O3、CaO、MgO等雜質),該燒渣可用于制取氧化鐵,具體化工生產工藝流程如下:
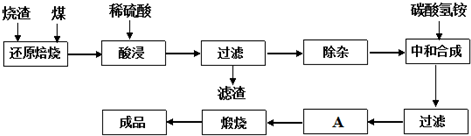
(1)焙燒時產生的主要有害氣體是.
(2)若在空氣中“酸浸”時間過長,溶液中Fe2+含量將下降,其原因是:(用離子方程式表示).
(3)根據下表數據:
在“除雜”步驟中,為除去Fe3+和Al3+,溶液的pH最大值應小于氫氧化物 Al(OH)3 Fe(OH)3 Fe(OH)2 開始沉淀的pH 3.10 2.01 7.11 完全沉淀的pH 4.77 3.68 9.61 ,檢驗Fe3+已經除盡的試劑是(除KSCN外).
(4)“中和合成”的目的是將溶液中Fe2+轉變為碳酸亞鐵沉淀,則A的操作是.發布:2025/1/19 8:0:1組卷:12引用:1難度:0.1


