回答下列問題:
(1)碳原子的核外電子排布式為 1s22s22p21s22s22p2。與碳同周期的非金屬元素N的第一電離能大于O的第一電離能,原因是 N原子的2p軌道達到半充滿結構,比較穩定N原子的2p軌道達到半充滿結構,比較穩定。
(2)A、B均為短周期金屬元素。依據下表數據,寫出B原子的電子排布式:1s22s22p63s21s22s22p63s2。
| 電離能/(kJ?mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
| 元素 | I1/eV | I2/eV | I3/eV |
| 甲 | 5.7 | 47.4 | 71.8 |
| 乙 | 7.7 | 15.1 | 80.3 |
| 丙 | 13.0 | 23.9 | 40.0 |
| 丁 | 15.7 | 27.6 | 40.7 |
A
A
(填字母)。A.甲的金屬性比乙強
B.乙的化合價為+1價
C.丙不可能為非金屬元素
D.丁一定為金屬元素
(4)Mn、Fe均為第四周期過渡金屬元素,兩元素的部分電離能數據列于下表:
| 元素 | Mn | Fe | |
| 電離能/(kJ?mol-1) | I1 | 717 | 759 |
| I2 | 1 509 | 1561 | |
| I3 | 3 248 | 2957 | |
3d5
3d5
,比較兩元素的I2、I3可知,氣態Mn2+再失去1個電子比氣態Fe2+再失去1個電子難,對此你的解釋是 Mn2+轉化為Mn3+時,3d能級由較穩定的3d5半充滿狀態轉變為不穩定的3d4狀態需要的能量較多,而Fe2+轉化為Fe3+時,3d能級由不穩定的3d6狀態轉變為較穩定的3d5半充滿狀態需要的能量相對要少
Mn2+轉化為Mn3+時,3d能級由較穩定的3d5半充滿狀態轉變為不穩定的3d4狀態需要的能量較多,而Fe2+轉化為Fe3+時,3d能級由不穩定的3d6狀態轉變為較穩定的3d5半充滿狀態需要的能量相對要少
。【考點】元素電離能、電負性的含義及應用;原子核外電子排布.
【答案】1s22s22p2;N原子的2p軌道達到半充滿結構,比較穩定;1s22s22p63s2;A;3d5;Mn2+轉化為Mn3+時,3d能級由較穩定的3d5半充滿狀態轉變為不穩定的3d4狀態需要的能量較多,而Fe2+轉化為Fe3+時,3d能級由不穩定的3d6狀態轉變為較穩定的3d5半充滿狀態需要的能量相對要少
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:65引用:2難度:0.6
相似題
-
1.已知Al、Mg、Na為第三周期元素,其原子的第一至第四電離能如下表:
(1)則Al、Mg、Na的電負性從大到小的順序為電離能/kJ?mol-1 I1 I2 I3 I4 X 578 1817 2745 11578 Y 738 1451 7733 10540 Z 496 4562 6912 9543 ;
(2)C、N、O、H是周期表中前10號元素,它們的原子半徑依次減小,H能分別與C、N、O形成電子總數相等的分子CH4、NH3、H2O。
①在CH4、NH3、H2O分子中,C、N、O三原子都采取雜化;
②CH4是含有鍵(填“極性”或“非極性”)的分子(填“極性”或“非極性”);
③NH3是一種易液化的氣體,請簡述其易液化的原因;
④H2O分子的VSEPR模型的空間構型為,H2O分子的空間構型為;
(3)K、Cr、Cu三種元素的原子序數依次增大,三原子的核外的最外層電子排布均為4s1。
①K元素組成的單質的晶體堆積模型為(填代號);
a.簡單立方堆積
b.體心立方堆積
c.六方最密堆積
d.面心立方最密堆積
②Cr元素在其化合物中最高化合價為;
③Cu2+離子的核外電子排布式為。發布:2025/1/5 8:0:1組卷:3引用:1難度:0.7 -
2.鐵及其化合物在生產生活及科學研究方面應用非常廣泛。
(1)基態Fe原子的價層電子的電子排布圖為,其最外層電子的電子云形狀為。
(2)(NH4)2Fe(SO4)2?6H2O俗稱摩爾鹽。
①O、S兩元素的電負性由大到小的順序為(用元素符號表示)。
②N、O兩元素的第一電離能由大到小的順序為(用元素符號表示)。
③SO42-中S原子的雜化方式為,VSEPR模型名稱為。
(3)Fe3+可與某陰離子發生特征的顯色反應,用于鑒定Fe3+.該陰離子的電子式為,σ鍵和π鍵的數目之比為。其空間構型為。
(4)K3[Fe(CN)6]晶體中配離子的配位體為(用化學符號表示)發布:2025/1/5 8:0:1組卷:19引用:1難度:0.6 -
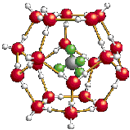 3.我國在青藏高原發現大儲量可燃冰.可燃冰的晶體結構模型如圖:
3.我國在青藏高原發現大儲量可燃冰.可燃冰的晶體結構模型如圖:
(1)C、N、O三種元素第一電離能由大到小的排列順序是>>(填元素符號),H2O分子中O原子的雜化方式為.
(2)“可燃冰”晶體內部存在的作用力有.
(3)下列有關“可燃冰”的說法中,不正確的是.
A.“可燃冰”的存在說明甲烷易溶于水
B.“可燃冰”屬于分子晶體,熔點較低
C.相同條件下,“可燃冰”的密度比冰的大
D.“可燃冰”只能在低溫、高壓環境下穩定存在
(4)晶體中平均每46個水分子構成8個籠,每個籠可容納1個CH4分子或1個H2O分子,每8個籠中有6個容納CH4分子,2個籠填充H2O分子,則“可燃冰”(天然氣水合物)的平均組成可表示為.發布:2024/12/31 8:0:1組卷:23引用:1難度:0.3


