 某學(xué)習(xí)小組設(shè)計(jì)研究醋酸的性質(zhì)。
某學(xué)習(xí)小組設(shè)計(jì)研究醋酸的性質(zhì)。
(1)研究稀釋過程導(dǎo)電能力變化。
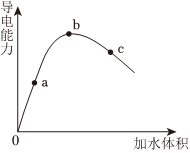
冰醋酸稀釋過程,溶液導(dǎo)電能力變化如圖所示,則a、b、c三點(diǎn)對應(yīng)溶液中,醋酸電離程度由大到小的順序是 c>b>ac>b>a(填字母)。用濕潤的pH試紙測定a點(diǎn)pH,結(jié)果 偏小偏小(填“偏大”、“偏小”或“準(zhǔn)確”)。
(2)研究稀釋過程pH變化。
25℃時(shí),用pH計(jì)測定不同濃度醋酸溶液的pH,結(jié)果如下:
| 醋酸濃度(mol/L) | 0.0010 | 0.01000 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.83 |
正
正
(填“正”或“逆”)向移動(dòng);結(jié)合表中數(shù)據(jù)得出判斷理由是 醋酸溶液稀釋10倍,而pH增大值小于1
醋酸溶液稀釋10倍,而pH增大值小于1
。(3)對比強(qiáng)、弱酸的性質(zhì)。
構(gòu)建模型可幫助理解問題。鹽酸和醋酸的“冰山”理解模型如圖,回答問題:
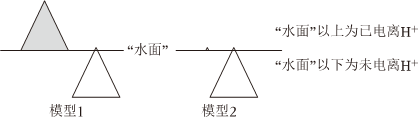
①模型1表示的是
A
A
(填序號)。A.等濃度的鹽酸和醋酸
B.等pH的鹽酸和醋酸溶液
②等體積,pH均為1的鹽酸和醋酸溶液,中和NaOH的能力比較:鹽酸
<
<
醋酸(填“>”、“<”或“=”)。③模型2表示的兩種溶液中分別加水,醋酸溶液中n(H+)
增大
增大
,c(H+) 減小
減小
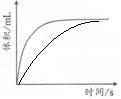
(填“增大”、“減小”或“不變”)。④過量鎂粉分別與2mL2mol/L鹽酸、2mL2mol/L醋酸溶液反應(yīng),測得鎂粉與鹽酸反應(yīng)生成氣體體積隨時(shí)間變化如圖,在圖中畫出鎂粉與醋酸溶液反應(yīng)的圖象

【考點(diǎn)】弱電解質(zhì)的電離平衡.
【答案】c>b>a;偏小;正;醋酸溶液稀釋10倍,而pH增大值小于1;A;<;增大;減小;

【解答】
【點(diǎn)評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:15引用:1難度:0.7
相似題
-
1.用水稀釋0.1mol/L的醋酸溶液,其中隨加水量的增加而增大的有( )
A.C(CH3COOH) B.C(H+) C.C(H+)/C(CH3COOH) D.C(CH3COOH)/C(H+) 發(fā)布:2025/1/1 8:0:2組卷:3引用:1難度:0.9 -
2.25℃時(shí),用蒸餾水稀釋0.10mol?L-1的醋酸,若用KW表示水的離子積常數(shù),則下列各式表 示的數(shù)值隨水量的增加而增大的是( )
A. [CH3COOH][H+]B. [CH3COO-][CH3COOH]C. [H+]kWD. [H+][OH-]發(fā)布:2025/1/1 8:0:2組卷:1引用:1難度:0.7 -
3.將0.1mol?L-1的醋酸溶液加水稀釋,則( )
A.中和此溶液所需的0.1 mol?L-1 NaOH溶液的體積增加 B.c(CH3COOH)減小,平衡向電離方向移動(dòng),c(CH3COO-)增大 C.平衡向電離方向移動(dòng),c(CH3COOH)、c(H+)、c(OH-)、c(CH3COO-)均減小 D.電離程度增大,由CH3COOH電離出的n(H+)變大 發(fā)布:2025/1/1 8:0:2組卷:6引用:1難度:0.7


