2022-2023學(xué)年廣東省佛山市南海區(qū)高二(上)期中化學(xué)試卷
發(fā)布:2025/1/2 5:30:4
一、選擇題:本題共16小題,共44分。第1~10小題,每小題2分;第11~16小題,每小
-
1.煎煮中藥一般分四步:冷水浸泡、加熱煎制、箅渣取液、灌裝保存。下列說法不正確的是( )
A.中藥藥液密封保存可減緩氧化速率 B.箅渣取液涉及冷卻結(jié)晶操作 C.中藥切片可使有效成分更充分浸出 D.加熱煎制是為了提高中藥的浸出效率 組卷:5引用:1難度:0.7 -
2.鹽類水解在生活中應(yīng)用廣泛,下列生活實例與鹽類水解無關(guān)的是( )
A.用明礬除去污水中的懸浮雜質(zhì) B.古代用草木灰的水溶液洗滌衣物 C.焊接鋼材前用 NH4Cl溶液除去焊點表面鐵銹 D.“管道通”中含有鋁和苛性鈉,可以疏通下水道 組卷:29引用:2難度:0.6 -
3.下列關(guān)于燃燒熱的熱化學(xué)方程式書寫正確的是( )
A.2H2+O2=2H2O△H=-571.6kJ/mol B.CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=+890.3kJ/mol C.4NH3(g)+3O2(g)=2N2(g)+6H2O△H=-1269kJ/mol D.C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol 組卷:13引用:1難度:0.7 -
4.無機阻燃劑Al(OH)3作用原理為:2Al(OH)3(s)=Al2O3(s)+3H2O(g)。關(guān)于Al(OH)3阻燃反應(yīng)的焓變和熵變說法正確的是( )
A.△H>0,△S>0 B.△H>0,△S<0 C.△H<0,△S>0 D.△H<0,△S<0 組卷:23引用:1難度:0.8 -
5.在水溶液中因發(fā)生水解而呈現(xiàn)酸性的物質(zhì)是( )
A.NaHSO4 B.NaHCO3 C.(NH4)2SO4 D.Na2S 組卷:11引用:1難度:0.7 -
6.恒溫恒容容器中反應(yīng):4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-907kJ/mol。下列條件的改變對正反應(yīng)速率幾乎無影響的是( )
A.充入稀有氣體 B.升高反應(yīng)溫度 C.增大氧氣濃度 D.添加合適的催化劑 組卷:65引用:2難度:0.6
二、非選擇題:本題共4題,共56分。
-
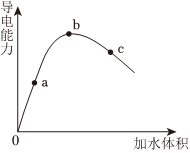 19.某學(xué)習(xí)小組設(shè)計研究醋酸的性質(zhì)。
19.某學(xué)習(xí)小組設(shè)計研究醋酸的性質(zhì)。
(1)研究稀釋過程導(dǎo)電能力變化。
冰醋酸稀釋過程,溶液導(dǎo)電能力變化如圖所示,則a、b、c三點對應(yīng)溶液中,醋酸電離程度由大到小的順序是(填字母)。用濕潤的pH試紙測定a點pH,結(jié)果(填“偏大”、“偏小”或“準(zhǔn)確”)。
(2)研究稀釋過程pH變化。
25℃時,用pH計測定不同濃度醋酸溶液的pH,結(jié)果如下:
根據(jù)表中數(shù)據(jù),稀釋醋酸溶液,電離平衡醋酸濃度(mol/L) 0.0010 0.01000 0.0200 0.1000 0.2000 pH 3.88 3.38 3.23 2.88 2.83 (填“正”或“逆”)向移動;結(jié)合表中數(shù)據(jù)得出判斷理由是。
(3)對比強、弱酸的性質(zhì)。
構(gòu)建模型可幫助理解問題。鹽酸和醋酸的“冰山”理解模型如圖,回答問題: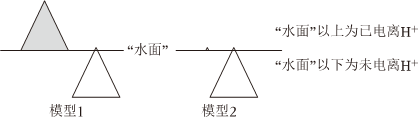
①模型1表示的是(填序號)。
A.等濃度的鹽酸和醋酸
B.等pH的鹽酸和醋酸溶液
②等體積,pH均為1的鹽酸和醋酸溶液,中和NaOH的能力比較:鹽酸醋酸(填“>”、“<”或“=”)。
③模型2表示的兩種溶液中分別加水,醋酸溶液中n(H+),c(H+)(填“增大”、“減小”或“不變”)。
④過量鎂粉分別與2mL2mol/L鹽酸、2mL2mol/L醋酸溶液反應(yīng),測得鎂粉與鹽酸反應(yīng)生成氣體體積隨時間變化如圖,在圖中畫出鎂粉與醋酸溶液反應(yīng)的圖象。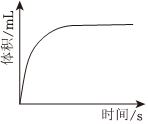 組卷:15引用:1難度:0.7
組卷:15引用:1難度:0.7 -
20.亞硝酸是一種弱酸,Ka(HNO2)=5.6×10-4,NaNO2可用于滴定分析。

(1)常溫下,0.1mol/L的NaNO2溶液呈(填“酸性”、“中性”或“堿性”);原因是(用離子方程式表示)。
(2)0.1mol/LNaNO2溶液中部分微粒組分及濃度如圖所示,X表示的是(填寫微粒化學(xué)式)。c()+c(HNO2)=NO-2mol/L。
(3)NaNO2用于測藥物中對氨基苯磺酸(Ar-NH2)的含量。測定原理為:酸性環(huán)境中,NaNO2先轉(zhuǎn)化為HNO2:HX+NaNO2=HNO2+NaX,HNO2再與Ar-NH2以物質(zhì)的量比1:1發(fā)生反應(yīng)。
①下列酸中,能作為HX來使用的是。
A.醋酸(Ka=1.8×10-5)
B.鹽酸
C.次氯酸(Ka=4.0×10-8)
②反應(yīng)體系中,Ar-NH2和少量KI共存時,HNO2會先與Ar-NH2完全反應(yīng)后,再氧化KI。滴定時用KI-淀粉糊劑作指示劑,滴定終點時淀粉糊劑顯色。
③用該法測定含Ar-NH2(Mr=173)藥物樣品的純度,每次取0.400g樣品,用0.100mol/LNaNO2標(biāo)準(zhǔn)溶液進(jìn)行滴定,實驗結(jié)果如下:
則該樣品中對氨基苯磺酸的純度是滴定次數(shù) 1 2 3 4 消耗NaNO2溶液體積/mL 20.12 20.90 20.00 19.88 。
第二次實驗數(shù)據(jù)出現(xiàn)異常,造成這種異常的原因可能是(填代號)。
a.錐形瓶洗凈后未干燥
b.滴定終點時俯視讀數(shù)
c.裝標(biāo)準(zhǔn)溶液的滴定管未用標(biāo)準(zhǔn)溶液潤洗
(4)已知298K時,H2CO3的Ka1=4.2×10-7、Ka2=5.61×10-11。將濃度均為0.1mol/L的Na2CO3及HNO2溶液等體積混合,溶液中陰離子濃度由大到小的順序為。組卷:27引用:1難度:0.5


