銅的配合物在自然界中廣泛存在,請回答下列問題:
(1)基態29Cu的核外電子排布式為 1s22s22p63s23p63d104s11s22s22p63s23p63d104s1。
(2)硫酸銅溶液中存在多種微粒:
①硫酸銅溶液呈藍色的原因是其中存在配離子 [Cu(H2O)4]2+[Cu(H2O)4]2+(填化學式),配體中提供孤電子對的原子是 OO(填元素符號)。
②用價電子對互斥理論對以下微粒的空間構型進行分析,完成下表:
| 微粒 | 中心原子上的孤電子對數 | 中心原子上的 價電子對總數 |
價電子對互斥理論(VSEPR)模型名稱 | 分子或離子 空間結構名稱 |
| H2O |
2 2
|
4 4
|
四面體 四面體
|
V形 V形
|
SO 2 - 4 |
0 0
|
4 4
|
四面體 四面體
|
正四面體形 正四面體形
|
SO
2
-
4
sp3
sp3
、sp3
sp3
。(3)同學甲設計如下制備銅的配合物的實驗:
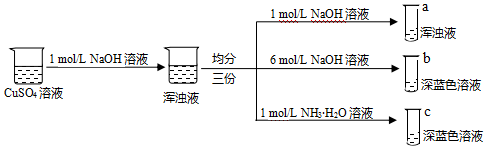
已知:銅離子的配位數通常為4。
①結合化學平衡原理原理解釋試管c中渾濁液轉變為深藍色溶液的原因
渾濁液中存在平衡:Cu(OH)2(s)?Cu2+(aq)+2OH-(aq),加入NH3?H2O后Cu2+與NH3配位形成[Cu(NH3)4]2+,c(Cu2+)降低,使得平衡正向移動,渾濁液轉變為深藍色溶液
渾濁液中存在平衡:Cu(OH)2(s)?Cu2+(aq)+2OH-(aq),加入NH3?H2O后Cu2+與NH3配位形成[Cu(NH3)4]2+,c(Cu2+)降低,使得平衡正向移動,渾濁液轉變為深藍色溶液
。②由上述實驗可得出以下結論:
結論1:配合物的形成與
配體的濃度
配體的濃度
、配體的種類
配體的種類
有關;結論2:結合上述實驗,試管b、c中深藍色配離子的穩定性強弱順序為:
[Cu(NH3)4]2+
[Cu(NH3)4]2+
>[Cu(OH)4]2-
[Cu(OH)4]2-
(填化學式)。【答案】1s22s22p63s23p63d104s1;[Cu(H2O)4]2+;O;2;4;四面體;V形;0;4;四面體;正四面體形;sp3;sp3;渾濁液中存在平衡:Cu(OH)2(s)?Cu2+(aq)+2OH-(aq),加入NH3?H2O后Cu2+與NH3配位形成[Cu(NH3)4]2+,c(Cu2+)降低,使得平衡正向移動,渾濁液轉變為深藍色溶液;配體的濃度;配體的種類;[Cu(NH3)4]2+;[Cu(OH)4]2-
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:55引用:2難度:0.6
相似題
-
1.在液氨中投入金屬鈉,迅速溶劑化得到藍色電子液[Na+(NH3)x和e-(NH3)y]且過程中有少量H2產生。下列說法正確的是( )
A.液氨為電解質 B.電子通過配位鍵和NH3結合 C.e-(NH3)y和Na+(NH3)x示意圖為: 
D.鈉與液氨的反應可表示為:2Na+2NH3═2NaNH2+H2↑ 發布:2025/1/4 8:0:1組卷:22引用:3難度:0.6 -
2.ZnSO4溶于氨水形成[Zn(NH3)4]SO4,其中配離子[Zn(NH3)4]2+的立體構型為正四面體形。下列說法正確的是( )
A.[Zn(NH3)4]SO4里只含有共價鍵 B.[Zn(NH3)4]SO4中配體的VSEPR模型是四面體形 C.1mol[Zn(NH3)4]SO4固體中σ鍵的數目為16mol D.若用2個Cl-替換[Zn(NH3)4]2+中的2個NH3,可得到2種新的配離子 發布:2025/1/5 8:0:1組卷:58引用:1難度:0.5 -
3.Pt(NH3)2Cl2可以形成兩種固體,一種為淡黃色,在水中的溶解度小,另一種為黃綠色,在水中的溶解度較大,請回答下列問題:
(1)Pt(NH3 )2 Cl2是平面正方形結構,還是四面體結構.
(2)請畫出這兩種固體分子的幾何構型圖,淡黃色固體:. 黃綠色固體:.
(3)淡黃色固體物質是由分子組成,黃綠色固體物質是由分子組成(填“極性分子”或“非極性分子”)發布:2024/12/30 17:0:2組卷:75引用:3難度:0.1


