2020-2021學年北京市豐臺區高二(下)期末化學試卷
發布:2024/4/20 14:35:0
一.本題共14小題,每小題只有一個選項符合題意,每小題3分,共42分
-
1.化學與生活息息相關。下列說法錯誤的是( )
A.花生油屬于油脂 B.糖類是指有甜味的有機化合物 C.α-氨基酸是構成蛋白質的結構單元 D.酒精使蛋白質變性起到消毒作用 組卷:54引用:3難度:0.8 -
2.下列有機物易溶于水的是( )
A.乙醇 B.乙烷 C.苯 D.乙酸乙酯 組卷:32引用:1難度:0.7 -
3.下列有關
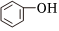 和
和 的敘述正確的是( )
的敘述正確的是( )A.都屬于醇類 B.都屬于酚類 C.二者屬于同系物 D.都能與Na反應 組卷:36引用:3難度:0.7 -
4.下列各類物質中,不能發生水解反應的是( )
A.乙酰胺( 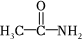 )
)B.葡萄糖 C.蛋白質 D.淀粉 組卷:45引用:2難度:0.8 -
5.2-丙醇(
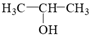 )的核磁共振氫譜吸收峰數目是( )
)的核磁共振氫譜吸收峰數目是( )A.1 B.2 C.3 D.4 組卷:38引用:2難度:0.7 -
6.下列分子中屬于極性分子的是( )
A.C60 B.C2H2 C.NH3 D.CO2 組卷:55引用:2難度:0.7
二.第Ⅱ卷(非選擇題共58分)
-
19.電負性與電離能是兩種定量描述元素原子得失電子能力的參數,請回答下列問題:
(1)非金屬性強弱:O元素符號 H C O F Mg Al Cl 電負性 2.1 2.5 3.5 4.0 1.2 1.5 3.0 Cl(填“>”或“<”)。
(2)依據電負性數值,上述元素的原子最容易形成離子鍵的是和(填元素符號)。
(3)某元素Y,其基態原子核外有2個電子層,3個未成對電子,該元素是(填元素符號),Y元素電負性的取值范圍是。
(4)二氟化氧的結構式為F-O-F,氧元素的化合價為,該分子屬于分子(填“極性”或“非極性”)。
(5)已知苯可與ICl發生取代反應,利用電負性相關知識預測反應產物: +I-Cl一定條件+
+I-Cl一定條件+
(6)隨著原子序數的遞增,元素氣態基態原子的第一電離能呈現起伏變化,而電負性的規律性更強。結合原子核外電子排布式解釋Mg的第一電離能比Al的高的原因。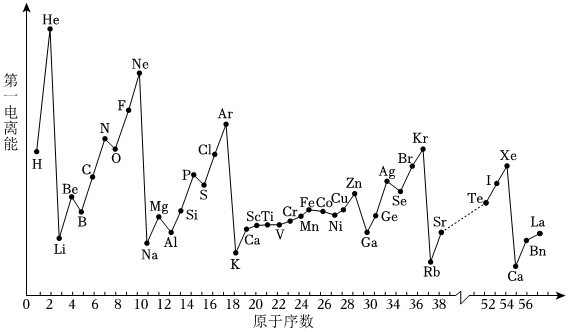 組卷:81引用:3難度:0.6
組卷:81引用:3難度:0.6 -
20.銅的配合物在自然界中廣泛存在,請回答下列問題:
(1)基態29Cu的核外電子排布式為。
(2)硫酸銅溶液中存在多種微粒:
①硫酸銅溶液呈藍色的原因是其中存在配離子(填化學式),配體中提供孤電子對的原子是(填元素符號)。
②用價電子對互斥理論對以下微粒的空間構型進行分析,完成下表:
③H2O、微粒 中心原子上的孤電子對數 中心原子上的
價電子對總數價電子對互斥理論(VSEPR)模型名稱 分子或離子
空間結構名稱H2O SO2-4中心原子的雜化軌道類型分別為SO2-4、。
(3)同學甲設計如下制備銅的配合物的實驗: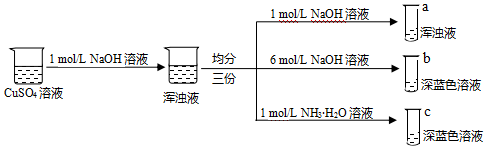
已知:銅離子的配位數通常為4。
①結合化學平衡原理原理解釋試管c中渾濁液轉變為深藍色溶液的原因。
②由上述實驗可得出以下結論:
結論1:配合物的形成與、有關;
結論2:結合上述實驗,試管b、c中深藍色配離子的穩定性強弱順序為:>(填化學式)。組卷:55引用:2難度:0.6


