學生甲利用如圖1所示實驗裝置來測定鎂元素的相對原子質(zhì)量。將一定質(zhì)量的鎂帶和過量的1mol?L-1稀硫酸在Y形管中完全反應,通過計算測出鎂元素的相對原子質(zhì)量。
(1)實驗中配制100mL的1mol?L-1稀硫酸需要 5.45.4mL的密度為1.84g/mL濃度為98%的濃硫酸。
(2)配制該稀硫酸過程中需要使用的玻璃儀器有 10mL量筒10mL量筒、燒杯燒杯、玻璃棒玻璃棒、膠頭滴管膠頭滴管、250mL容量瓶250mL容量瓶。
(3)配制稀硫酸的過程中,以下操作對硫酸溶液濃度的影響(填“偏高”、“偏低”、“無影響”):
洗滌液未轉(zhuǎn)移入容量瓶 偏低偏低;轉(zhuǎn)移過程中溶液濺到桌面 偏低偏低;未冷卻至室溫即轉(zhuǎn)移并定容 偏高偏高;使用的容量瓶不干燥 無影響無影響。
(4)Y形管中發(fā)生反應化學方程式為 Mg+2HCl═MgCl2+H2↑Mg+2HCl═MgCl2+H2↑。
(5)學生甲的實驗數(shù)據(jù)如下:消耗鎂帶的質(zhì)量為0.025g,產(chǎn)生H2的體積(已折合成標準狀況)為24mL,由此計算得出鎂元素的相對原子質(zhì)量為 23.323.3 (保留1位小數(shù)),相對偏差為 -4.1%-4.1%。目前國際公認的鎂元素的相對原子質(zhì)量為24.3,則如果測得的鎂原子量偏小,在實驗中可能引起誤差的原因是 CC(填編號,多選扣分)
A.鎂帶中含有與硫酸不反應的雜質(zhì)
B.沒有除去鎂帶表面的氧化鎂
C.鎂帶中含有雜質(zhì)鋁
D.所用稀硫酸不足量
(6)學生乙利用實驗室常用的儀器,也組裝了一套與學生甲具有相同原理的實驗裝置。你認為學生乙應選用下列儀器(如圖2)中的 ADAD (填編號,多選扣分)。
【考點】相對分子質(zhì)量的測定.
【答案】5.4;10mL量筒;燒杯;玻璃棒;膠頭滴管;250mL容量瓶;偏低;偏低;偏高;無影響;Mg+2HCl═MgCl2+H2↑;23.3;-4.1%;C;AD
【解答】
【點評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:13引用:1難度:0.6
相似題
-
1.實驗室用粗鋅與稀硫酸反應制取氫氣,利用氫氣還原氧化銅來測定銅的相對原子質(zhì)量。實驗裝置如下:
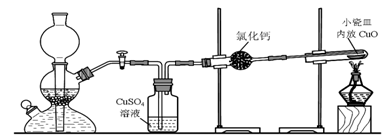
(1)在啟普發(fā)生器中純鋅與稀硫酸反應過于緩慢,可采取的加快速率的措施是:①,②。
(2)用純度不高的鋅(粗鋅)制取氫氣,反應速率快,但制得的氫氣因含H2S等還原性雜質(zhì)而有難聞的氣味,CuSO4洗氣瓶中觀察到的現(xiàn)象是有黑色沉淀生成,請寫出該洗氣瓶中發(fā)生復分解反應的化學方程式,是否可以將CuSO4溶液換成濃硫酸(答“是”或“否”);理由是。請簡述用CuSO4溶液配制檢驗醛基的新制氫氧化銅的方法。
(3)裝置中氯化鈣的作用是。有同學發(fā)現(xiàn)粗鋅與稀硫酸反應一段時間后,鋅粒表面變黑,于是收集了少量該黑色固體,驗證黑色固體含鐵元素的化學方法。
(4)實驗中得到的數(shù)據(jù)有:小瓷皿的質(zhì)量mg,小瓷皿加樣品的質(zhì)量n g,反應后小瓷皿加固體的質(zhì)量w g,已知氧的相對原子質(zhì)量為16,則銅的相對原子質(zhì)量是(用含m、n、w的代數(shù)式表示)。發(fā)布:2024/11/24 8:0:2組卷:65引用:1難度:0.6 -
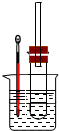 2.某液態(tài)鹵代烷RX(R是烷基,X是某種鹵素原子)的密度是a g/cm3.該RX可以跟稀堿發(fā)生水解反應生成ROH(能跟水互溶)和HX.為了測定RX的相對分子質(zhì)量,擬定的實驗步驟如下:
2.某液態(tài)鹵代烷RX(R是烷基,X是某種鹵素原子)的密度是a g/cm3.該RX可以跟稀堿發(fā)生水解反應生成ROH(能跟水互溶)和HX.為了測定RX的相對分子質(zhì)量,擬定的實驗步驟如下:
①準確量取該鹵代烷b mL,放入大試管中;
②在大試管中加入過量稀NaOH溶液,塞上帶有長玻璃管的塞子,加熱,發(fā)生反應(如圖所示);
③反應完成后,冷卻溶液,加稀HNO3酸化,滴加過量AgNO3溶液,得白色沉淀;
④過濾,洗滌,干燥后稱重,得到c g固體.
回答下面問題:
(1)裝置中長玻璃管的作用是;
(2)該鹵代烴中所含鹵素的名稱是,判斷依據(jù)是;
(3)該鹵代烴的相對分子質(zhì)量是(列出算式);如果在步驟③中加HNO3的量不足,沒有將溶液酸化,則步驟④中測得的c值(填選項代碼)A.偏大 B.偏小 C.不變.發(fā)布:2024/12/30 9:0:1組卷:32引用:2難度:0.5 -
3.實驗室用粗鋅與稀硫酸反應制取氫氣,利用氫氣還原氧化銅來測定銅的相對原子質(zhì)量.實驗裝置如下:
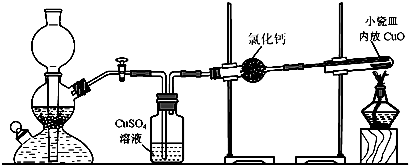
(1)在啟普發(fā)生器中純鋅與稀硫酸反應過于緩慢,可采取的加快速率的措施是①適當增大硫酸的濃度,②.
(2)用純度不高的鋅(粗鋅)制取氫氣,反應速率快,但制得的氫氣因含H2S等還原性雜質(zhì)而有難聞的氣味,CuSO4洗氣瓶中觀察到的現(xiàn)象是,是否可以將CuSO4溶液換成濃硫酸(答“是”或“否”);理由是.
(3)有同學發(fā)現(xiàn)粗鋅與稀硫酸反應一段時間后,鋅粒表面變黑,于是收集了少量該黑色固體,驗證黑色固體含鐵元素的簡單化學方法.
(4)實驗中得到的數(shù)據(jù)有:小瓷皿的質(zhì)量mg,小瓷皿加樣品的質(zhì)量n g,反應后小瓷皿加固體的質(zhì)量w g,已知氧的相對原子質(zhì)量為16,則銅的相對原子質(zhì)量是(用含m、n、w的代數(shù)式表示).
(5)某次實驗中測定結(jié)果明顯偏大,可能的原因是(選填編號).
a.未充分冷卻即停止通氫氣 b.氧化銅樣品中含有氯化銨雜質(zhì)
c.反應后固體中有少量Cu2O d.氫氣不干燥有少量水分
(6)由于啟普發(fā)生器藥品用量較多,利用下列儀器裝配一套有啟普發(fā)生器功能的簡易裝置,你選擇(選填編號) (支撐儀器、橡皮塞、導氣管略).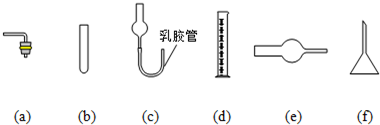 發(fā)布:2024/11/24 8:0:2組卷:41引用:1難度:0.5
發(fā)布:2024/11/24 8:0:2組卷:41引用:1難度:0.5
相關(guān)試卷


