高鐵酸鉀(K2FeO4)是一種新型、高效、多功能綠色水處理劑,已知:
①NaClO在較高溫度下發(fā)生歧化反應生成NaClO3。
②K2FeO4具有下列性質:可溶于水、微溶于濃KOH溶液;在強堿性溶液中比較穩(wěn)定;在Fe3+催化作用下發(fā)生分解,在酸性至弱堿性條件下,能與水反應生成Fe(OH)3和O2實驗室以次氯酸鹽和鐵鹽為原料制備少量K2FeO4的操作步驟如下:
Ⅰ.制備NaClO強堿性飽和溶液:
①將20mL NaOH溶液加入儀器b中,冷水浴冷卻,通入Cl2,攪拌,直至溶液變?yōu)辄S綠色且有少量白色晶體析出為止(裝置如圖所示)。

②將所得飽和NaClO倒入燒杯并置于冷水浴中,分幾次加入20g NaOH固體并不斷攪拌,過濾,得NaClO強堿性飽和溶液。
(1)甲裝置中a管的作用是 平衡壓強,使漏斗內的液體能順利滴下平衡壓強,使漏斗內的液體能順利滴下。
(2)寫出甲裝置中反應的化學方程式 2KMnO4+16HCl(濃)=2KCl+2MnCl2+5Cl2↑+8H2O2KMnO4+16HCl(濃)=2KCl+2MnCl2+5Cl2↑+8H2O。
(3)石灰乳的作用是 除去未反應的氯氣,防止氯氣污染空氣除去未反應的氯氣,防止氯氣污染空氣。
(4)反應過程中用冷水浴冷卻的原因是 有利于氯氣與氫氧化鈉溶液反應生成次氯酸鈉有利于氯氣與氫氧化鈉溶液反應生成次氯酸鈉。
Ⅱ.合成K2FeO4:
①稱取5.05g Fe(NO3)3?9H2O(相對分子質量為404)固體,在冷水浴中分批加入Ⅰ中所得濾液,并不斷攪拌,反應1小時后溶液呈深紫紅色(即Na2FeO4)。
②離心分離除去Na2FeO4水解得到的Fe(OH)3膠體,留上層清液(深紫紅色)。
③向②的上層清液中緩慢加入KOH飽和溶液50.00mL,冰水浴保持5min,過濾,得K2FeO4[M(K2FeO4)=198g/mol]粗產(chǎn)品。
④將粗產(chǎn)品重結晶,并洗滌,低溫烘干,得純產(chǎn)品2.13g。
(5)工業(yè)上常用廢鐵屑為原料制備Fe(NO3)3溶液,檢驗Fe3+所需試劑名稱 硫氰化鉀溶液硫氰化鉀溶液,其反應原理為 Fe3++3SCN-=Fe(SCN)3Fe3++3SCN-=Fe(SCN)3(用離子方程式表示);合成Na2FeO4的離子方程式為 2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O。
(6)過程③加入飽和KOH溶液即可得到K2FeO4粗產(chǎn)品,析出K2FeO4固體,過濾、洗滌、干燥。洗滌操作所用最佳試劑為 BB。
A.水
B.無水乙醇
C.稀KOH溶液
(7)K2FeO4的產(chǎn)率為 86.1%86.1%(保留至0.1%)。
【考點】制備實驗方案的設計.
【答案】平衡壓強,使漏斗內的液體能順利滴下;2KMnO4+16HCl(濃)=2KCl+2MnCl2+5Cl2↑+8H2O;除去未反應的氯氣,防止氯氣污染空氣;有利于氯氣與氫氧化鈉溶液反應生成次氯酸鈉;硫氰化鉀溶液;Fe3++3SCN-=Fe(SCN)3;2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;B;86.1%
【解答】
【點評】
聲明:本試題解析著作權屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復制發(fā)布。
發(fā)布:2024/4/20 14:35:0組卷:35引用:1難度:0.6
相似題
-
1.硫鐵礦燒渣是硫鐵礦生產(chǎn)硫酸過程中產(chǎn)生的工業(yè)廢渣(主要含F(xiàn)e2O3及少量SiO2、Al2O3等雜質).用該燒渣制取藥用輔料--紅氧化鐵的工藝流程如下:
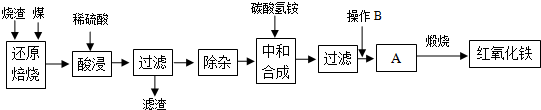
(1)在“還原焙燒”中產(chǎn)生的有毒氣體可能有.
(2)“酸浸”時間一般不超過20min,若在空氣中酸浸時間過長,溶液中Fe2+含量將下降,其原因是(用離子方程式表示).
(3)根據(jù)下表數(shù)據(jù):
在“除雜”步驟中,為除去Fe3+和Al3+,溶液的pH最大值應小于氫氧化物 Al(OH)3 Fe(OH)3 Fe(OH)2 開始沉淀的pH 3.10 2.01 7.11 完全沉淀的pH 4.77 3.68 9.61 ,檢驗
Fe3+已經(jīng)除盡的試劑是.
(4)“中和合成”的目的是將溶液中Fe2+轉變?yōu)樘妓醽嗚F沉淀,則操作B是.
(5)煅燒A的反應方程式是.
(6)a g燒渣經(jīng)過上述工藝可得紅氧化鐵b g.藥典標準規(guī)定,制得的紅氧化鐵中含氧化鐵不得少于98.0%,則所選用的燒渣中鐵的質量分數(shù)應不低于(用含a、b的表達式表示).發(fā)布:2025/1/19 8:0:1組卷:5引用:1難度:0.5 -
2.硫鐵礦燒渣是硫鐵礦生產(chǎn)硫酸過程中產(chǎn)生的工業(yè)廢渣(主要含F(xiàn)e2O3及少量SiO2、Al2O3、CaO、MgO等雜質).用該燒渣制取藥用輔料--紅氧化鐵的工藝流程如圖:
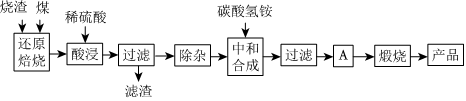
(1)在“還原焙燒”中產(chǎn)生的有毒氣體可能有.
(2)“酸浸”時間一般不超過20min,若在空氣中酸浸時間過長,溶液中Fe2+含量將下降,其原因是(用離子方程式表示).
(3)根據(jù)下表數(shù)據(jù):
在“除雜”步驟中,為除去Fe3+和Al3+,溶液的pH最大值應小于氫氧化物 Al(OH)3 Mg(OH)2 Fe(OH)3 Fe(OH)2 開始沉淀的pH 3.10 8.54 2.01 7.11 完全沉淀的pH 4.77 11.04 3.68 9.61 ,檢驗Fe3+已經(jīng)除盡的試劑是;當pH=5時,溶液中c(Al3+)=mol?L-1(已知常溫下Ksp[Al(OH)3]=2.0×10-33).
(4)“中和合成”的目的是將溶液中Fe2+轉變?yōu)樘妓醽嗚F沉淀,則A的操作是.
(5)a g燒渣經(jīng)過上述工藝可得紅氧化鐵b g.藥典標準規(guī)定,制得的紅氧化鐵中含氧化鐵不得少于98.0%,則所選用的燒渣中鐵的質量分數(shù)應不低于(用含a、b的表達式表示).發(fā)布:2025/1/19 8:0:1組卷:114引用:4難度:0.5 -
3.硫鐵礦燒渣是硫鐵礦生產(chǎn)硫酸過程中產(chǎn)生的工業(yè)廢渣(主要含F(xiàn)e2O3及少量SiO2、Al2O3、CaO、MgO等雜質).用該燒渣制取藥用輔料--紅氧化鐵的工藝流程如下:
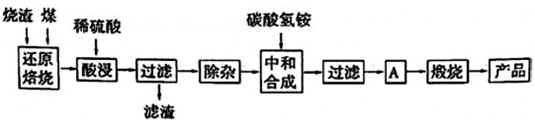
(1)在“還原焙燒”中產(chǎn)生的有毒氣體可能有.
(2)“酸浸”時間一般不超過20min,若在空氣中酸浸時間過長,溶液中Fe2+含量將下降,其原因是(用離子方程式表示).
(3)根據(jù)下表數(shù)據(jù):
在“除雜”步驟中,為除去Fe3+和Al3+,溶液的pH最大值應小于氫氧化物 Al(OH)3 Mg(OH)2 Fe(OH)3 Fe(OH)2 開始沉淀的pH 3.10 8.54 2.01 7.11 完全沉淀的pH 4.77 11.04 3.68 9.61 ,常溫下,當pH=5時,溶液中c(Al3+)=mol?L-1(已知常溫下Ksp[Al(OH)3]═2.0×10-33).
(4)“中和合成”的目的是將溶液中Fe2+轉變?yōu)樘妓醽嗚F沉淀,則A的操作是.發(fā)布:2025/1/19 8:0:1組卷:12引用:1難度:0.5


