我國著名化學家侯德榜發明的“聯合制堿法”的反應原理用化學方程式可簡要表示為:NH3+CO2+H2O=NH4HCO3,NH4HCO3+NaCl=NaHCO3+NH4Cl;2NaHCO3 △ Na2CO3+H2O+CO2↑。
(1)純堿屬于 鹽鹽(填“酸”“堿”或“鹽”)。
(2)檢驗碳酸氫鈉中含有碳酸鈉的方法是 取固體少許加入適量蒸餾水溶解,然后向溶液中滴加氯化鋇(或氯化鈣)溶液,有白色沉淀產生,證明驗碳酸氫鈉固體中含有碳酸鈉雜質取固體少許加入適量蒸餾水溶解,然后向溶液中滴加氯化鋇(或氯化鈣)溶液,有白色沉淀產生,證明驗碳酸氫鈉固體中含有碳酸鈉雜質。
(3)NH4HCO3+NaCl=NaHCO3+NH4Cl,請寫出該反應能發生的原因 由于碳酸氫鈉的溶解度小,容易從溶液中析出NaHCO3晶體,導致反應的發生由于碳酸氫鈉的溶解度小,容易從溶液中析出NaHCO3晶體,導致反應的發生。
(4)向含有碳酸鈉和碳酸氫鈉的溶液中逐滴滴加1mol/L鹽酸,產生標準狀況下氣體的體積與鹽酸體積關系如圖所示:
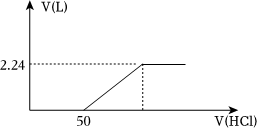
①逐滴滴加鹽酸的過程中HCO-3物質的量變化趨勢是 先變大,后減小先變大,后減小;
②上述混合溶液碳酸氫鈉的物質的量是 0.05mol0.05mol。
△
HCO
-
3
【答案】鹽;取固體少許加入適量蒸餾水溶解,然后向溶液中滴加氯化鋇(或氯化鈣)溶液,有白色沉淀產生,證明驗碳酸氫鈉固體中含有碳酸鈉雜質;由于碳酸氫鈉的溶解度小,容易從溶液中析出NaHCO3晶體,導致反應的發生;先變大,后減小;0.05mol
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/9/9 11:0:12組卷:171引用:2難度:0.7


