碲(Te)被譽為“現代工業、國防與尖端技術的維生素,創造人間奇跡的橋梁”。實驗室模擬提取碲的一個實驗是:取某含碲溶液于燒瓶中,加入適量NaCl,加熱到一定溫度,持續通入SO2,待反應一定時間,過濾得到粗碲。
(1)反應的總化學方程式為:TeOSO4+2SO2+3X △ Te↓+3H2SO4,則X為H2OH2O(填化學式)。
(2)為探究獲得較高粗碲沉淀率的反應條件,某研究小組在控制NaCl濃度和SO2流量不變的條件下,進行下述對比試驗,數據如下:
△
| 實驗 | 溫度/℃ | 反應時間/h | 粗蹄沉淀率 |
| a | 65 | 3.0 | 65.0 |
| b | 80 | 3.0 | 98.9 |
| c | 80 | 2.0 | 98.9 |
| d | 90 | 2.0 | 97.0 |
溫度
溫度
和反應時間
反應時間
。②實驗a和b的目的是
比較相同時間,不同的反應溫度對粗碲沉淀率的影響
比較相同時間,不同的反應溫度對粗碲沉淀率的影響
。③在上述四組實驗中,最佳的反應條件是
80
80
℃和2.0
2.0
h。④為了提升設備利用效率和節約能源,可進一步優化反應條件測定粗碲沉淀率。若再設計對比實驗,選擇的反應條件還可以是
A
A
(填選項)。A.80℃,1.5h B.80℃,2.5h C.70℃,2.0h D.95℃,2.0h。
【考點】物質的相互轉化和制備;質量守恒定律及其應用.
【答案】H2O;溫度;反應時間;比較相同時間,不同的反應溫度對粗碲沉淀率的影響;80;2.0;A
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:249引用:13難度:0.5
相似題
-
1.新冠肺炎疫情防控期間,西安市各學校開展全域噴灑低濃度、有效成分是次氯酸鈉的“84”消毒液進行消毒。如圖所示是模擬制備“84”消毒液的流程(Cl2是一種黃綠色的有毒氣體)。請回答下列問題:
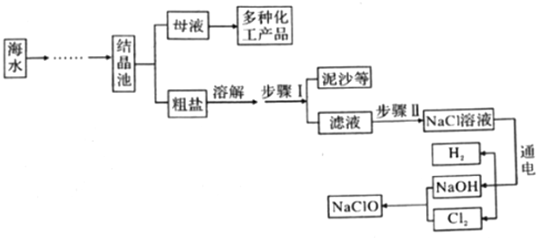
(1)NaOH的俗稱為(寫一種)。
(2)步驟Ⅱ中,通常用碳酸鈉溶液除去濾液中的氯化鈣雜質,請寫出有關反應的化學方程式。
(3)電解水時,一般在水中加入少量NaOH以增強水的導電性,不能加入NaCl的原因是。發布:2025/1/3 8:0:1組卷:6引用:1難度:0.5 -
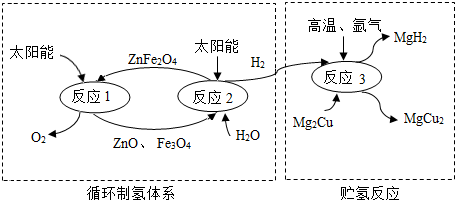 2.如圖是制取與貯存氫氣的一種方法,Mg2Cu是一種貯氫合金,吸氫后生成MgH2和MgCu2合金的混合物(M),MgH2+2HCl═MgCl2+2H2↑,下列說法不正確的是( )
2.如圖是制取與貯存氫氣的一種方法,Mg2Cu是一種貯氫合金,吸氫后生成MgH2和MgCu2合金的混合物(M),MgH2+2HCl═MgCl2+2H2↑,下列說法不正確的是( )A.ZnFe2O4中Fe的化合價為+3價 B.循環制氫反應中無需加入ZnFe2O4 C.反應1和反應2的總方程式為:2H2O 2H2↑+O2↑通電D.M與足量稀鹽酸反應生成的H2質量大于反應2產生的H2質量 發布:2024/12/31 8:0:1組卷:48引用:2難度:0.5 -
3.某種家用的消毒液的主要成分是次氯酸鈉(NaClO),制取NaClO的化學方程式為:Cl2+2NaOH=NaClO+NaCl+H2O,下列說法錯誤的是( )
A.NaClO中氯元素的化合價為-1 B.反應中用到的NaOH俗稱燒堿 C.該化學方程式中涉及到兩種鹽 D.反應前后氯元素化合價既升高又降低 發布:2025/1/3 8:0:1組卷:71引用:1難度:0.7


