某研究性學習小組設計如下實驗裝置進行探究。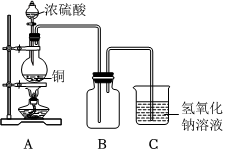
(1)裝置A中反應的化學方程式為 Cu+2H2SO4(濃) △ CuSO4+SO2↑+2H2OCu+2H2SO4(濃) △ CuSO4+SO2↑+2H2O。
(2)實驗結束后,欲驗證A中生成的氣體在裝置B中被氧化,小組同學取裝置B中溶液少量于一潔凈的試管中,應向試管中加入的試劑是 CC。(填字母)
A.品紅溶液
B.稀鹽酸
C.BaCl2溶液
D.稀硝酸
(3)實驗結束,小組同學立即熄滅酒精燈,可能導致的后果是 裝置B中的溶液會倒吸,可能引起燒瓶破裂裝置B中的溶液會倒吸,可能引起燒瓶破裂。
(4)實驗中若有mg 銅參加了反應,則有 m64m64molH2SO4被還原,轉移電子數目為 m32NAm32NA(設NA為阿伏加德羅常數的值)。
(5)為了測定消耗H2SO4的物質的量,該興趣小組設計了兩個實驗方案。
方案一:將裝置A 產生的氣體緩緩通過已稱量過的裝有堿石灰的干燥管,反應停止后再次稱量干燥管的質量,兩次的質量差即是吸收的二氧化硫的質量。
方案二:將裝置A產生的氣體緩緩通入足量的用硫酸酸化的高錳酸鉀溶液中,再加入足量的氯化鋇溶液,過濾、洗滌、干燥,稱得沉淀的質量即是二氧化硫轉化為硫酸鋇沉淀的質量。實際上,方案一和方案二均不可取。
方案一:由于產生的氣體中含有 水蒸氣水蒸氣使再次稱量的干燥管的質量偏大;也可能由于 燒瓶中的二氧化硫不能完全排出燒瓶中的二氧化硫不能完全排出使再次稱量的干燥管的質量偏小。
方案二:由于 高錳酸鉀溶液中起酸化作用的硫酸高錳酸鉀溶液中起酸化作用的硫酸與氯化鋇溶液反應,使測定的消耗H2SO4的物質的量偏大。
△
△
m
64
m
64
m
32
m
32
【考點】氮氧化物的相互轉化.
【答案】Cu+2H2SO4(濃) CuSO4+SO2↑+2H2O;C;裝置B中的溶液會倒吸,可能引起燒瓶破裂;;NA;水蒸氣;燒瓶中的二氧化硫不能完全排出;高錳酸鉀溶液中起酸化作用的硫酸
△
m
64
m
32
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:75引用:2難度:0.6
相似題
-
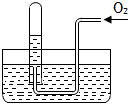 1.如圖所示,試管中盛裝的是紅棕色氣體(可能是混合物),當倒扣在盛有水的水槽中時,試管內水面上升,但不能充滿試管,當向試管內鼓入氧氣后,可以觀察到試管中水柱繼續上升,經過多次重復后,試管內完全被水充滿,原來試管中盛裝的可能是什么氣體( )
1.如圖所示,試管中盛裝的是紅棕色氣體(可能是混合物),當倒扣在盛有水的水槽中時,試管內水面上升,但不能充滿試管,當向試管內鼓入氧氣后,可以觀察到試管中水柱繼續上升,經過多次重復后,試管內完全被水充滿,原來試管中盛裝的可能是什么氣體( )A.可能是N2與NO2的混和氣體 B.可能是O2與NO2的混和氣體 C.可能是NO與NO2的混和氣體 D.可能是NO2一種氣體 發布:2024/5/27 14:0:0組卷:288引用:12難度:0.5 -
2.對下列事實的解釋,方程式不正確的是( )
A.氯水保存于棕色試劑瓶:2HClO H2↑+Cl2↑+O2↑光B.不能用排水法收集NO2:3NO2+H2O═2HNO3+NO C.高溫熔融態鐵遇水爆炸:3Fe+4H2O Fe3O4+4H2,2H2+O2高溫2H2O高溫D.硫酸鋁與碳酸氫鈉制泡沫滅火器:Al3++3HCO3-═Al(OH)3↓+3CO2↑ 發布:2024/5/27 14:0:0組卷:174引用:1難度:0.5 -
3.化學與生產生活密切相關。下列說法正確的是( )
A.海水資源的綜合利用涉及制鹽、制取鎂和溴等,其過程中均涉及氧化還原反應 B.用食醋和淀粉可檢驗食鹽里是否加碘 C.氮氧化合物與“光化學煙霧”、“臭氧層空洞”、“硝酸型酸雨”的形成有關 D.由于鈍化的原因,常溫下可用鋼瓶來裝載濃硫酸、濃硝酸、液氯等強氧化性液體 發布:2024/5/27 14:0:0組卷:155引用:1難度:0.7


