研究物質的性質與變化,實驗是較好的研究方法。已知足量的NaOH溶液能完全吸收SO2、CO2氣體。化學興趣小組設計如圖實驗裝置:

(1)用V形玻璃管完成如圖1、圖2所示實驗1和實驗2:
實驗1:如圖1所示,往V形玻璃管A處注入H2O2溶液,在B處下方加熱使硫粉燃燒,產生氣體通入C處后排放的目的是 吸收尾氣,避免造成污染吸收尾氣,避免造成污染;A處反應的文字(或符號)表達式是 過氧化氫二氧化錳水+氧氣或H2O2MnO2H2O+O2過氧化氫二氧化錳水+氧氣或H2O2MnO2H2O+O2。
實驗2:如圖2所示,先在B處放滴滿無色酚酞試液的長濾紙條,后向V形玻璃管A處加濃氨水,可觀察到B處的現象是 長濾紙條自左向右變紅長濾紙條自左向右變紅;若另取一相同的V形玻璃管(含相同的實驗藥品和用品),在A處稍加熱,在更短的時間內可觀察到上述現象,請從微觀角度解釋:溫度升高,分子運動速率加快溫度升高,分子運動速率加快。
(2)用圖3、圖4裝置完成實驗3和實驗4,兩組裝置氣密性良好:
實驗3:用圖3所示裝置進行實驗,實驗步驟如下:
①將白磷放在燃燒匙內,塞好橡皮塞;
②從長頸漏斗向瓶內迅速注入60℃的水至剛剛浸沒白磷;
③連接好注射器,向瓶內推入空氣,瓶內水面下降,當白磷露出水面時停止推入空氣,并關閉K,白磷立即燃燒;
④白磷熄滅,冷卻過程中,瓶內水面上升,最后淹沒白磷。
請回答:步驟④中瓶內水面上升的原因是 氧氣被消耗,氣體減少,同時反應接觸,溫度降低,造成內部壓強減少,外界大氣壓將長頸漏斗內水壓入集氣瓶內,使瓶內液面上升氧氣被消耗,氣體減少,同時反應接觸,溫度降低,造成內部壓強減少,外界大氣壓將長頸漏斗內水壓入集氣瓶內,使瓶內液面上升。
實驗4:用圖4所示裝置進行實驗:
①關閉K,打開甲的橡皮塞,點燃硫粉后迅速塞緊橡皮塞;
②冷卻至常溫,將膠頭滴管中的足量NaOH溶液擠入瓶中,振蕩使反應充分;
③打開K,觀察乙中的現象。
下列說法不正確的是 BB。
A.①中,硫燃燒呈淡藍色火焰
B.②中,甲裝置內的氣壓減少,最終與大氣壓相等
C.③中,乙中的長導管下口處冒氣泡
二氧化錳
M
n
O
2
二氧化錳
M
n
O
2
【考點】探究氧氣的性質.
【答案】吸收尾氣,避免造成污染;過氧化氫水+氧氣或H2O2H2O+O2;長濾紙條自左向右變紅;溫度升高,分子運動速率加快;氧氣被消耗,氣體減少,同時反應接觸,溫度降低,造成內部壓強減少,外界大氣壓將長頸漏斗內水壓入集氣瓶內,使瓶內液面上升;B
二氧化錳
M
n
O
2
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:167引用:1難度:0.3
相似題
-
1.某化學興趣小組在做“鐵絲在氧氣里燃燒”實驗時,進行了一系列探究活動。
探究一:鐵絲燃燒是否需要純氧
【實驗內容】取0.38mm的鐵絲,分別在體積分數為90%、70%、60%、55%的氧氣中實驗。
【討論】
(1)空氣中氧氣的含量按20%計,用集氣瓶收集含氧氣60%的氣體的方法可以是:。
【實驗】
【結論】O2% 90% 70% 60% 55% 實驗現象 燃燒劇烈、燃燒時間長,效果好 燃燒比90%弱,燃燒時間短,實驗成功 燃燒比70%弱,燃燒時間更短,實驗成功 難以燃燒只是發紅
(2)就0.38mm鐵絲而言,燃燒所需氧氣的最低體積分數為,且氧氣濃度越大,燃燒現象越(填“劇烈”或“不劇烈”)。
探究二:鐵絲燃燒產生火星四射的原因
(3)圖中螺旋狀鐵絲的末端系一根火柴的作用是。
(4)對鐵絲在氧氣中燃燒為什么會火星四射進行探究。下表是將純鐵絲和不同含碳量的鐵絲(鐵絲直徑為0.4mm)放入氧氣中燃燒時的實驗現象的記錄。請分析完成下表:
通過以上實驗,說明鐵絲燃燒產生火星四射現象和物質 純鐵絲 含碳0.05%的鐵絲 含碳0.2%的鐵絲 含碳0.6%的鐵絲 燃燒時的現象 無火星四射現象,熔斷 劇烈燃燒,極少火星 劇烈燃燒,少量火星 (填元素符號)有關。發布:2024/10/13 12:0:2組卷:42引用:2難度:0.5 -
2.小明對鐵絲在氧氣中燃燒為什么會火星四射進行探究。下表是他純鎂條和不同含碳量的鐵絲(鎂條和鐵絲直徑均為0.4mm)放入氧氣中燃燒時的實驗現象的記錄。請你分析回答:
(1)表中“A”處內容應為物質 鎂條 含碳0.05%的鐵絲 含碳0.2%的鐵絲 含碳0.6%的鐵絲 燃燒時的現象 劇烈燃燒,
無火星。劇烈燃燒
極少火星劇烈燃燒
少量火星A 。
(2)鎂條燃燒的化學式表達式為。
(3)通過以上探究,你認為鐵絲燃燒產生火星四射現象的原因可能是;實驗時,鐵絲需繞成螺旋狀的目的是,為防止瓶底炸裂,需,鐵絲燃燒的化學式表達式為。
(4)鐵除了可以在氧氣中燃燒,還可以在空氣中發生緩慢氧化,該過程(填“放熱”或“吸熱”);在生活中緩慢氧化的例子很多,下列也屬于緩慢氧化的是(填序號)。
①鍋爐爆炸 ②動植物的呼吸 ③食物的腐爛 ④水結成冰 ⑤酒和醋的釀造 ⑥農家肥的腐熟 ⑦火藥爆炸
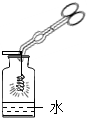
(5)某同學利用鐵粉來測定空氣中氧氣的含量,如圖所示,將足量的鐵粉用水均勻地粘在試管內壁上,將試管倒立在裝有水的燒杯中。實驗過程中,觀察到試管內液面緩慢上升。下列分析錯誤的是
A.水能進入試管的最大體積為試管容積的1/5
B.該鐵粉在試管內發生了氧化反應
C.這一實驗可以驗證空氣的組成不是單一的
D.如果把鐵粉改為木炭粉,兩者的現象完全相同發布:2024/11/4 8:0:2組卷:22引用:1難度:0.5 -
 3.做完“鐵在氧氣里燃燒”實驗后,某興趣小組有一些疑惑不解的問題,于是他們進行了以下探究活動,請你一同參與。
3.做完“鐵在氧氣里燃燒”實驗后,某興趣小組有一些疑惑不解的問題,于是他們進行了以下探究活動,請你一同參與。
【問題】細鐵絲在氧氣中燃燒為什么會“火星四射”?
【查閱資料1】①日常生活中的鋼鐵制品都含有少量碳雜質。
②含碳細鐵絲燃燒時,其中的炭粒生成的CO2氣體在熔融液態物質中形成氣泡,熔融液態物質因氣泡炸裂引起“火星四射”的現象。
(1)(設計實驗)為了探究細鐵絲在純氧中燃燒產生“火星四射”現象的原因,該小組同學設計的實驗方案是:取長短粗細相同的含碳細鐵絲和不含碳的細鐵絲,分別在足量的氧氣中燃燒,觀察現象。你認為他們的方案(填“合理”或“不合理”)。
(2)(實驗探究)小明做細鐵絲在氧氣中的燃燒實驗時,他把細鐵絲繞成螺旋狀,一端系在一根鐵絲上,另一端系上一根火柴。點燃火柴后迅速把鐵絲連同火柴一起插入集氣瓶下部(沒有接觸到水,如圖所示),但不見鐵絲燃燒,反復實驗均未成功。
該同學認為可能導致失敗的原因主要有三種:
A.鐵絲表面有銹跡,影響了反應的進行;
B.點燃火柴后立即將它伸入瓶內,火柴燃燒消耗了氧氣,不利于鐵絲的燃燒;
C.火柴燃燒時有大量的熱量放出,將鐵絲和火柴迅速伸至集氣瓶下部,因熱脹冷縮之故。瓶內氧氣會膨脹逸出,使鐵絲無法燃燒。
針對假設A應作出的實驗改進為;
針對假設B應作出的實驗改進為;
針對假設C應作出的實驗改進為。
(3)【查閱資料2】①黑色的Fe3O4和紅色的Fe2O3的分解溫度、鐵的熔點見下表:
②Fe2O3高溫時分解成Fe3O4
③FeO不穩定,容易被空氣中的氧氣氧化成Fe2O3
(理論探討)根據鐵絲燃燒的實驗現象,并結合表中數據,可推知鐵在氧氣里燃燒時產生的高溫應在Fe3O4 Fe2O3 鐵 分解溫度℃ 1538 1400 — 熔點/℃ — — 1535 之間,在此溫度范圍內Fe2O3已分解,所以鐵在氧氣里燃燒的產物是Fe3O4,其化學反應方程式。
(4)[拓展延伸]有些超市的食品密封包裝盒的透明蓋內放有黑色的FeO粉末,若粉末的顏色,就說明包裝盒破損進氣,這樣售貨員就能及時發現并處理。發布:2024/10/16 5:0:1組卷:52引用:1難度:0.5


