普通干電池在生活中的用途很廣。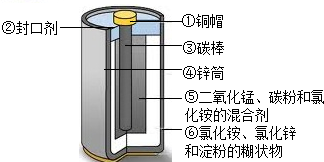
(1)普通干電池照明時化學能轉化為電能電能。
(2)目前,廢舊電池對環境的污染已越來越引起人們的重視。為了實現可持續發展的戰略目標,許多有識之士正在研究廢舊電池的有效回收再利用技術。右圖為普通電池(鋅錳電池)示意圖,請你根據圖示分析:將回收的廢舊電池進行分離,可以得到的金屬單質有(用化學式表示,下同)Zn、CuZn、Cu,氧化物有MnO2MnO2,鹽有NH4Cl、ZnCl2NH4Cl、ZnCl2,有機物有淀粉淀粉(寫名稱)。
(3)小明同學想得到⑤中純凈干燥的二氧化錳和氯化銨溶液,并檢驗氯化銨中的銨根離子。 設計了如下實驗步驟,請你幫他完成。
| 實驗步驟 | 實驗現象 | 結論或解釋 |
| ①剝開干電池,取出碳棒周圍的黑色粉末 | ||
| ②溶解、 過濾 過濾 、洗滌(填操作名稱) |
得到黑色粉末和無色澄清液體 | 黑色粉末的成分為 二氧化錳、碳粉 二氧化錳、碳粉 。 |
| ③對黑色粉末進行 灼燒 灼燒 |
得到純凈的MnO2固體 | |
| ④檢驗第②步中得到的無色澄清液體中是否含銨根離子的方法是: 取樣于試管中,加入氫氧化鈉溶液并加熱 取樣于試管中,加入氫氧化鈉溶液并加熱 |
產生刺激性氣味的氣體 產生刺激性氣味的氣體
|
化學方程式為: NH4Cl+NaOH=NaCl+H2O+NH3↑ NH4Cl+NaOH=NaCl+H2O+NH3↑ |
溶液變藍色,析出銀白色固體
溶液變藍色,析出銀白色固體
,反應的化學方程式是Cu+2AgNO3=Cu(NO3)2+2Ag
Cu+2AgNO3=Cu(NO3)2+2Ag
,其基本反應類型為置換
置換
反應。【答案】電能;Zn、Cu;MnO2;NH4Cl、ZnCl2;淀粉;過濾;二氧化錳、碳粉;灼燒;取樣于試管中,加入氫氧化鈉溶液并加熱;產生刺激性氣味的氣體;NH4Cl+NaOH=NaCl+H2O+NH3↑;溶液變藍色,析出銀白色固體;Cu+2AgNO3=Cu(NO3)2+2Ag;置換
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:26引用:3難度:0.5
相似題
-
1.下列混合物的分離方法不正確的是( )
A.泥沙和食鹽(溶解和過濾) B.水和酒精的混合物(蒸餾) C.硝酸鉀中混有少量食鹽(降溫結晶) D.汽油和水(過濾) 發布:2025/1/4 8:0:1組卷:6引用:0難度:0.5 -
2.下列各組物質的分離操作可按溶解、過濾、蒸發溶劑的順序進行的是( )
A.食鹽和蔗糖 B.銅粉和鐵粉 C.水和酒精的混合物 D.食鹽和泥沙 發布:2025/1/4 8:0:1組卷:6引用:1難度:0.7 -
3.下列各組物質的分離操作可按溶解、過濾、蒸發溶劑的順序進行的是( )
A.食鹽和沙子 B.銅粉、鐵粉 C.水和酒精的混合物 D.氧氣和氫氣 發布:2025/1/4 8:0:1組卷:10引用:1難度:0.7


