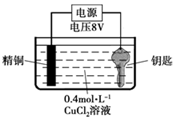
 某實驗小組嘗試在鋼制鑰匙上鍍銅。
某實驗小組嘗試在鋼制鑰匙上鍍銅。
實驗Ⅰ:將鑰匙直接浸入0.4 mol?L-1 CuCl2溶液中,20s后取出,鑰匙表面變紅,但鍍層疏松,用紙即可擦掉。
實驗Ⅱ:用圖裝置對鑰匙進行電鍍銅。鑰匙表面迅速變紅,同時有細小氣泡產生,精銅表面出現少量白色固體。30s后取出鑰匙檢驗,鍍層相對實驗I略好,但仍能用紙巾擦掉一部分。經調整實驗條件后獲得了較好的電鍍產品。
實驗Ⅲ:用0.4 mol?L-1 CuSO4溶液代替CuCl2溶液重復實驗Ⅱ,精銅表面未出現白色固體。
回答下列問題:
(1)實驗Ⅰ反應的化學方程式是Fe+CuCl2=Cu+FeCl2Fe+CuCl2=Cu+FeCl2。
(2)實驗Ⅱ中鑰匙應與電源的負負極連接。
(3)鑰匙表面產生的氣體是H2H2。
(4)為了避免實驗Ⅲ中鑰匙表面產生氣體,應該采取的措施是適當降低氫離子濃度或降低電源電壓等適當降低氫離子濃度或降低電源電壓等。
(5)常見化合物中銅元素有+1、+2兩種價態,結合實驗Ⅲ推測實驗Ⅱ中精銅表面產生的白色固體的電極反應式是Cu-e-+Cl-=CuClCu-e-+Cl-=CuCl。(已知CuOH是一種難溶于水的黃色固體)
【考點】金屬的腐蝕與防護.
【答案】Fe+CuCl2=Cu+FeCl2;負;H2;適當降低氫離子濃度或降低電源電壓等;Cu-e-+Cl-=CuCl
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:49引用:2難度:0.7
相似題
-
1.用如圖裝置進行鐵的電化學腐蝕實驗。下列說法正確的是( )一段時間后,左側試管發熱,導管口有氣泡產生。
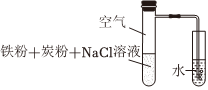
A.鐵發生的電極反應:Fe-3e-═Fe3+ B.鐵腐蝕過程中,化學能轉化為熱能 C.炭粉的存在對鐵腐蝕的速率無影響 D.導管口產生氣泡證明鐵發生了析氫腐蝕 發布:2024/12/12 1:30:1組卷:78引用:2難度:0.7 -
2.下列敘述與電化學腐蝕有關的是( )
A.炒過菜的鐵鍋不及時清洗易生銹 B.在空氣中金屬鎂具有較好的抗腐蝕性 C.紅熱的鐵絲與水接觸時,表面形成了藍黑色的物質 D.把鐵片投入到氯化銅溶液中,在鐵表面上附著一層紅色的銅 發布:2025/1/6 6:0:5組卷:4引用:3難度:0.7 -
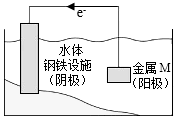 3.將金屬M連接在鋼鐵設施表面,可減緩水體中鋼鐵設施的腐蝕。在如圖所示的情境中,下列有關說法正確的是( )
3.將金屬M連接在鋼鐵設施表面,可減緩水體中鋼鐵設施的腐蝕。在如圖所示的情境中,下列有關說法正確的是( )A.鋼鐵設施表面因積累大量電子而被保護 B.金屬M的活動性比Fe的活動性弱 C.陰極的電極反應式為Fe-2e-=Fe2+ D.鋼鐵設施在河水中的腐蝕速率比在海水中的快 發布:2024/12/10 21:0:1組卷:106引用:4難度:0.7


