能源是國民經濟發展的重要基礎,如何合理利用現有能源以及開發新能源一直 是研究的重點課題。
(1)在 25℃、101kPa時,8gCH4完全燃燒生成液態水時放出的熱量是445.0kJ.在直接以甲烷為燃料電池時,電解質溶液為酸性,負極的反應式為CH4+2H2O-8e-=CO2+8H+CH4+2H2O-8e-=CO2+8H+。理想狀態下,該燃料電池消耗1mol甲烷所能產生的最大電能為 756.5kJ,則該燃料電池的理論效率(燃 料電池的理論效率是指電池所產生的最大電能與燃料電池反應所能釋放的全部能量之比)為85.0%85.0%。
(2)將煤轉化為水煤氣的方法是通過化學高溫方法將煤轉化為潔凈燃料的方法之一。煤轉化為水煤氣的主要反應為 C+H2O(g) 高溫 CO+H2.有關物質的燃燒熱數據如表所示:
高溫
| 物質 | C | H2 | CO |
| △H/kJ?mol-1 | -393.5 | -285.8 | -283.0 |
①寫出 C 完全燃燒的熱化學方程式:
C(s)+O2(g)=CO2(g)△H=-393.5 kJ/mol
C(s)+O2(g)=CO2(g)△H=-393.5 kJ/mol
。②相同條件下,相同體積的氫氣與一氧化碳完全燃燒,放出熱量較多的是
H2
H2
。③寫出煤轉化為水煤氣的主要反應的熱化學方程式:
C(s)+H2O(g)=CO(g)+H2(g)△H=+87.5kJ/mol
C(s)+H2O(g)=CO(g)+H2(g)△H=+87.5kJ/mol
。【考點】原電池與電解池的綜合.
【答案】CH4+2H2O-8e-=CO2+8H+;85.0%;C(s)+O2(g)=CO2(g)△H=-393.5 kJ/mol;H2;C(s)+H2O(g)=CO(g)+H2(g)△H=+87.5kJ/mol
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:3引用:1難度:0.5
相似題
-
1.某原電池結構如圖所示,下列有關該原電池的說法正確的是( )
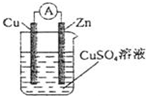
A.銅棒為負極 B.鋅棒發生還原反應 C.電子從銅棒經外電路流向鋅棒 D.鋅棒質量減輕 發布:2025/1/6 6:0:5組卷:417引用:11難度:0.9 -
2.關于如圖所示的原電池,下列說法正確的是( )
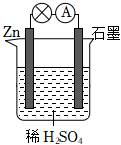
A.石墨電極上發生氧化反應 B.電子由鋅片通過導線流向石墨棒 C.該裝置將電能轉化為化學能 D.將稀硫酸換成乙醇,燈泡亮度不變 發布:2025/1/6 6:0:5組卷:83引用:5難度:0.8 -
3.一種新型短路膜電化學電池消除CO2裝置如圖所示。下列說法錯誤的是( )
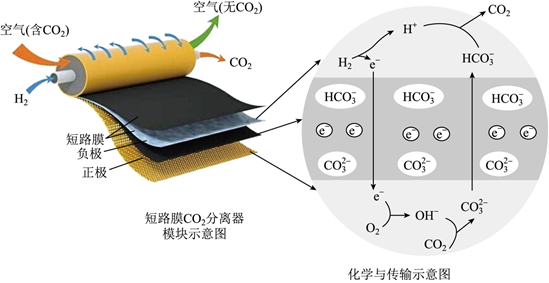
A.負極反應為:H2+2OH--2e-=2H2O B.正極反應消耗標準狀況下22.4LO2,理論上需要轉移4mol電子 C.短路膜和常見的離子交換膜不同,它既能傳遞離子,還可以傳遞電子 D.該裝置可用于空氣中CO2的捕獲,緩解溫室效應 發布:2024/12/30 19:30:2組卷:51引用:5難度:0.5


