我國對世界鄭重承諾:2030年前實現碳達峰,2060年前實現碳中和,而研發CO2的碳捕捉和碳利用技術則是關鍵。
(1)大氣中的CO2主要來自于煤、石油及其他含碳化合物的燃燒,CH4與CO2重整是CO2利用的研究熱點之一。該重整反應體系主要涉及以下反應:
①CH4(g)?C(s)+2H2(g) ΔH1=akJ?mol-1
②CO2(g)+H2(g)?CO(g)+H2O(g) ΔH2=bkJ?mol-1
③2CO(g)?CO2(g)+C(s) ΔH3=ckJ?mol-1
反應CH4(g)+CO2(g)?2CO(g)+2H2(g)的ΔH=(a-c)(a-c)kJ?mol-1。
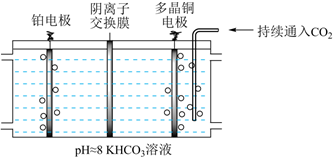
(2)多晶Cu是目前唯一被實驗證實能高效催化CO2還原為烴類(如C2H4)的金屬。如圖所示,電解裝置中分別以多晶Cu和Pt為電極材料,用陰離子交換膜分隔開陰、陽極室,反應前后KHCO3濃度基本保持不變,溫度控制在10℃左右。生成C2H4的電極反應式為 14CO2+12e-+8H2O=C2H4+12HCO-314CO2+12e-+8H2O=C2H4+12HCO-3。
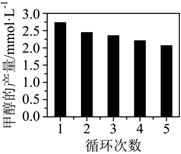
(3)CO2與H2反應如果用Co/C作為催化劑,可以得到含有少量甲酸的甲醇。為了研究催化劑的催化效率,將Co/C催化劑循環使用,相同條件下,隨著循環使用次數的增加,甲醇的產量如圖所示,試推測甲醇產量變化的可能原因 反應產生的甲酸腐蝕催化劑,使催化劑活性降低反應產生的甲酸腐蝕催化劑,使催化劑活性降低。
(4)常溫下,以NaOH溶液作CO2捕捉劑不僅可以降低碳排放,而且可得到重要的化工產品Na2CO3。用1LNa2CO3溶液將2.33gBaSO4固體全都轉化為BaCO3,再過濾,所用的Na2CO3溶液的物質的量濃度至少為 0.110.11mol?L-1。[已知:常溫下Ksp(BaSO4)=1×10-11,Ksp(BaCO3)=1×10-10;忽略溶液體積變化]
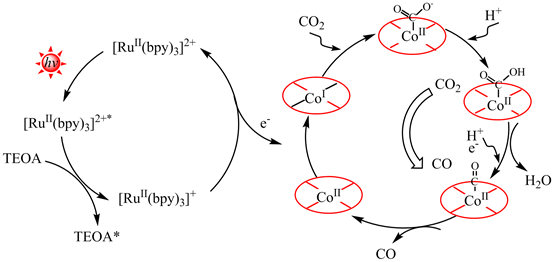
(5)某課題組通過溫和的自光刻技術制備出富含氧空位的Co(CO3)0.5(OH)?0.11H2O納米線(用CoII表示),測試結果表明,該CoII在可見光下具有優異的光催化CO2還原活性。分析表明,該CO2還原催化機理為典型的CoII/CoI反應路徑(如圖)。首先,光敏劑([Ru(bpy)3]2+)通過可見光照射被激發到激發態([Ru(bpy)3]2+*),隨后([Ru(bpy)3]2+*)被TEOA淬滅得到([Ru(bpy)3]+)還原物種,該還原物種將向CoII供激發電子將CoII還原為CoI,CoI失去一個電子轉化為CoII,同時失去的電子被轉移到吸附在光催化劑表面的CO2上生成CoIICOO-,CoIICOO-再結合一個H+轉化為CoIICOOH,H+得到一個電子和CoIICOOH結合生成CoIICO和H2O(CoIICOOH+H++e-=CoIICO+H2O),CO分子從CoIICO中解吸附釋放出CoI失去一個電子轉化為CoII,同時失去的電子被轉移到吸附在光催化劑表面的CO2上生成CoIICOO-,CoIICOO-再結合一個H+轉化為CoIICOOH,H+得到一個電子和CoIICOOH結合生成CoIICO和H2O(CoIICOOH+H++e-=CoIICO+H2O),CO分子從CoIICO中解吸附釋放出。(結合圖示,描述CO2還原為CO的過程)
HCO
-
3
HCO
-
3
【答案】(a-c);14CO2+12e-+8H2O=C2H4+12;反應產生的甲酸腐蝕催化劑,使催化劑活性降低;0.11;CoI失去一個電子轉化為CoII,同時失去的電子被轉移到吸附在光催化劑表面的CO2上生成CoIICOO-,CoIICOO-再結合一個H+轉化為CoIICOOH,H+得到一個電子和CoIICOOH結合生成CoIICO和H2O(CoIICOOH+H++e-=CoIICO+H2O),CO分子從CoIICO中解吸附釋放出
HCO
-
3
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:93引用:3難度:0.6
相似題
-
 1.第五主族的磷單質及其化合物在工業上有廣泛應用.
1.第五主族的磷單質及其化合物在工業上有廣泛應用.
(1)同磷灰石在高溫下制備黃磷的熱化學方程式為:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)△H已知相同條件下:4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H12Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g)△H2SiO2(s)+CaO(s)=CaSiO3(s)△H3用△H1、△H2和△H3表示△H,則△H=;
(2)白磷與氧氣反應生成P4O10固體.已知斷裂下列化學鍵需要吸收的能量分別為:P-P a kJ?mol-1、P-O b kJ?mol-1、P═O c kJ?mol-1、O═O d kJ?mol-1.根據圖1的分子結構和有關數據通過計算寫出該反應的熱化學方程式為.
(3)三聚磷酸可視為三個磷酸分子(磷酸結構式如圖2)之間脫去兩個水分子產物,其結構式為,三聚磷酸鈉(俗稱“五鈉”)是常用的水處理劑,其化學式為.
(4)次磷酸(H3PO2)為一元酸,分子中含一個羥基,其鈉鹽的正鹽的化學式為,該鹽可用于工業上的化學鍍鎳.①化學鍍鎳的溶液中含有Ni2+和H2PO2-,在酸性等條件下發生下述反應:
(a)□Ni2++□H2PO2-+□=□Ni++□H2PO3-+□
(b)6H2PO-2+2H+=2P+4H2PO3-+3H2↑請在答題卡上寫出并配平反應式(a);
②利用①中反應可在塑料鍍件表面沉積鎳-磷合金,從而達到化學鍍鎳的目的,這是一種常見的化學鍍.請從以下方面比較化學鍍與電鍍.原理上的不同點:;化學鍍的優點:.發布:2024/11/19 8:0:1組卷:77引用:2難度:0.1 -
2.已知在1200℃時,天然氣脫硫工藝中會發生下列反應:
①H2S(g)+O2(g)═SO2(g)+H2O(g) ΔH132
②2H2S(g)+SO2(g)═S2(g)+2H2O(g) ΔH232
③H2S(g)+O2(g)═S(g)+H2O(g) ΔH312
④2S(g)═S2(g) ΔH4
則ΔH4的正確表達式為( )A.ΔH4= (ΔH1+ΔH2-3ΔH3)23B.ΔH4= (3ΔH3-ΔH1-ΔH2)23C.ΔH4= (ΔH1+ΔH2-3ΔH3)32D.ΔH4= (ΔH1-ΔH2-3ΔH3)32發布:2024/12/6 13:30:1組卷:393引用:6難度:0.5 -
3.氨和聯氨(N2H4)是氮的兩種常見化合物,在科學技術和生產中有重要的應用.聯氨(又稱肼,N2H4或H2N-NH2,無色液體)是一種應用廣泛的化工原料,可用作火箭燃料.回答下列問題:
(1)聯氨分子的電子式為,其中氮的化合價為;
(2)實驗室中可用次氯酸鈉溶液與氨反應制備聯氨,該反應中還原劑與氧化劑的物質的量之比為2:1,反應的化學方程式為.
(3)①2O2(g)+N2(g)═N2O4(g)△H1
②ON2(g)+2H2(g)═N2H4(l)△H2
③O2(g)+2H2(g)═2H2O(g)△H3
④N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H4=-1038.6kJ?mol-1
上述反應熱效應之間的關系式為△H4=,聯氨和N2O4可作為火箭推進劑的主要原因為.
(4)聯氨可用作火箭燃料,燃燒時發生的反應是N2O4(l)+2N2O4(l)═3N2(g)+4H2O(g)△H=-1038.6kJ?mol-1,若該反應中有4molN-H鍵斷裂,則反應放出的熱量為kJ.發布:2024/11/18 8:0:1組卷:12引用:0難度:0.9


