某同學(xué)在超市購買餅干時發(fā)現(xiàn)配料表中有“碳酸氫銨”,感覺很驚訝,“碳酸氫銨”是化肥,怎么可以放進(jìn)食品中?于是開展了以下探究,請你幫助完成下列相關(guān)問題。
查閱資料:①食用級碳酸氫銨比較純凈,可作膨松劑;一般用在油炸食品中,水蒸食品中不用。
②常溫常壓下,1體積水約能溶解700體積氨氣,其水溶液呈弱堿性。
③堿石灰是氧化鈣和氫氧化鈉的混合物。
產(chǎn)生疑惑:化肥為何可以作膨松劑?為何一般適用于油炸食品而不適用于水蒸食品?

實驗設(shè)計:實驗裝置如圖,圖一是檢驗裝置,圖二是收集裝置,取適量碳酸氫銨分別置于兩試管中,按如圖進(jìn)行實驗。
(1)現(xiàn)象與分析:
①圖一:B中現(xiàn)象是溶液變紅,則碳酸氫銨受熱生成了 氨氣氨氣,C中澄清石灰水變渾濁,則發(fā)生反應(yīng)的化學(xué)方程式是 Ca(OH)2+CO2═CaCO3↓+H2OCa(OH)2+CO2═CaCO3↓+H2O。
②圖二:裝置E的作用是 吸收水和二氧化碳吸收水和二氧化碳,用F裝置收集氨氣,則燒杯中水的作用 吸收多余的氨氣,防止空氣污染吸收多余的氨氣,防止空氣污染。
(2)解釋與結(jié)論:
①有臭味的碳酸氫銨添加到食品中,如果油炸,則含有的少量碳酸氫銨受熱時完全分解,產(chǎn)生的氣體使食品膨脹,且生成物可以迅速揮發(fā)而離開食品,沒有殘留物,其臭味會消失。添加碳酸氫銨的食品如果水蒸,則 部分氨氣溶于水,影響口感部分氨氣溶于水,影響口感。通過上述探究應(yīng)該明白:高純度的碳酸氫銨可以作為食品添加劑,但同一食品添加劑并不適合所有食品,使用食品添加劑需嚴(yán)格控制用量。
②因為氨氣極易溶于水,圖三、圖四燒杯中盛有水,水可以進(jìn)入燒瓶形成噴泉,圖三如果形成噴泉,則實驗操作為 擠壓膠頭滴管中的水擠壓膠頭滴管中的水;圖四如果形成噴泉,則實驗操作為 打開止水夾后用熱毛巾捂住燒瓶,一段時間后松開即可或打開止水夾后用冷毛巾捂住燒瓶,一段時間后松開即可(合理即可)打開止水夾后用熱毛巾捂住燒瓶,一段時間后松開即可或打開止水夾后用冷毛巾捂住燒瓶,一段時間后松開即可(合理即可)。
【答案】氨氣;Ca(OH)2+CO2═CaCO3↓+H2O;吸收水和二氧化碳;吸收多余的氨氣,防止空氣污染;部分氨氣溶于水,影響口感;擠壓膠頭滴管中的水;打開止水夾后用熱毛巾捂住燒瓶,一段時間后松開即可或打開止水夾后用冷毛巾捂住燒瓶,一段時間后松開即可(合理即可)
【解答】
【點評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:39引用:2難度:0.5
相似題
-
1.碳酸氫鈉是一種應(yīng)用廣泛的鹽,化學(xué)小組對其進(jìn)行了探究。
(1)NaHCO3可稱為鈉鹽或碳酸氫鹽,它是由Na+和(填離子符號)構(gòu)成,醫(yī)療上能用于治療胃酸(含有鹽酸)過多癥,反應(yīng)的化學(xué)方程式為。
【提出問題】實驗室中如何制取少量NaHCO3?
【查閱資料】
材料一:侯氏制堿的原理:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;2NaHCO3Na2CO3+CO2↑+H2O。△
材料二:研究發(fā)現(xiàn),NaHCO3溶于水時吸收熱量,Na2CO3溶于水時放出熱量。
【實驗制備】根據(jù)侯氏制堿原理設(shè)計如圖1所示裝置制取NaHCO3。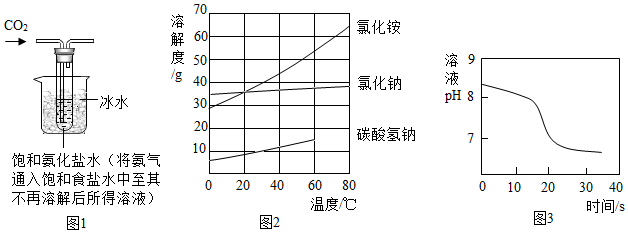
反應(yīng)結(jié)束后,將試管中的混合物過濾洗滌,低溫烘干得白色固體。
(2)燒杯中冰水的作用是。
(3)能進(jìn)一步確認(rèn)該白色固體是NaHCO3的實驗方案是(須用到的儀器和藥品:試管、溫度計、水)。
(4)如圖2中碳酸氫鈉的溶解度在60℃后無數(shù)據(jù)的原因可能是。
【性質(zhì)探究】
常溫下,取一定量的NaHCO3溶液于燒杯中,插入pH傳感器,向燒杯中持續(xù)滴加CaCl2溶液,有白色沉淀生成,當(dāng)溶液的pH變?yōu)?.68時開始有無色氣體產(chǎn)生。反應(yīng)過程中溶液的pH隨時間變化如圖3所示。
【查閱資料】
材料三NaHCO3溶于水后,少量的能同時發(fā)生如下變化:HCO-3
變化①:+H2O→H2CO3+OH-;HCO-3
變化②:→HCO-3+H+。CO2-3
材料四:溶液的酸堿性與溶液中H+和OH-數(shù)目的相對大小有關(guān)。常溫下,當(dāng)單位體積溶液中OH-的數(shù)目大于H+的數(shù)目時溶液的pH>7,反之pH<7;單位體積溶液中所含的H+數(shù)目越大,溶液的pH越小。
【交流反思】
(5)NaHCO3溶液顯(填“酸”“堿”或“中”)性,結(jié)合材料三、四從微觀角度說明原因:。
(6)根據(jù)本實驗,下列說法錯誤的是(填字母)。
a.pH<6.68時生成的無色氣體為CO2
b.從0~30s,單位體積溶液中H+數(shù)目不斷增大
c.不能用CaCl2溶液鑒別Na2CO3和NaHCO3溶液發(fā)布:2024/12/25 15:30:1組卷:586引用:4難度:0.5 -
2.關(guān)于鹽的性質(zhì)研究是一項重要的課題,某興趣小組以“探究碳酸氫鈉的性質(zhì)”為主題開展項目式學(xué)習(xí)。
【任務(wù)一】認(rèn)識碳酸氫鈉
(1)下列關(guān)于碳酸氫鈉的說法正確的是。
A.碳酸氫鈉是由Na+和構(gòu)成HCO-3
B.碳酸氫鈉俗稱純堿
C.碳酸氫鈉醫(yī)療上能用于治療胃酸過多癥
D.碳酸氫鈉難溶于水
【任務(wù)二】探究碳酸氫鈉的性質(zhì)
(2)探究碳酸氫鈉與稀鹽酸反應(yīng):興趣小組取適量碳酸氫鈉粉末于甲試管中,加入稀鹽酸,如圖1所示,觀察到甲試管中有氣泡產(chǎn)生,乙中,說明碳酸氫鈉能與稀鹽酸反應(yīng)生成CO2,寫出試管甲中反應(yīng)的化學(xué)方程式。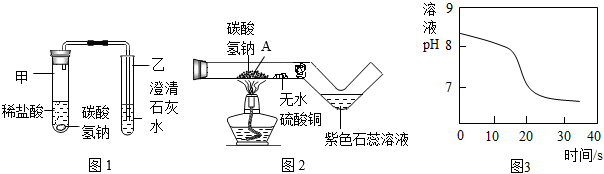
(3)探究碳酸氫鈉的熱穩(wěn)定性:用酒精燈充分加熱玻璃管,如圖2所示。
資料:無水硫酸銅呈白色,遇水后呈藍(lán)色
①發(fā)現(xiàn)玻璃管內(nèi)無水硫酸銅變藍(lán),紫色石蕊溶液變紅,說明碳酸氫鈉受熱易分解,且有和二氧化碳生成。
②實驗后興趣小組同學(xué)猜想玻璃管A處固體產(chǎn)物僅是Na2CO3而不含有NaOH,請設(shè)計實驗證明(寫出具體步驟和現(xiàn)象):。
(4)常溫下,興趣小組同學(xué)取一定量的NaHCO3溶液于燒杯中,插入pH傳感器,向燒杯中持續(xù)滴加CaCl2溶液,有白色沉淀生成,當(dāng)溶液的pH變?yōu)?.68時開始有無色氣體產(chǎn)生。反應(yīng)過程中溶液的pH隨時間變化如圖3所示。
【查閱資料】
材料一:NaHCO3溶于水后,少量的能同時發(fā)生如下變化:HCO-3
變化①:+H2O→H2CO3+OH-HCO-3
變化②:→HCO-3+H+CO2-3
材料二:溶液的酸堿性與溶液中H+和OH-數(shù)目的相對大小有關(guān)。常溫下,當(dāng)單位體積溶液中OH-的數(shù)目大于H+的數(shù)目時溶液的pH>7,反之pH<7;單位體積溶液中所含的H+數(shù)目越大,溶液的pH越小。
①根據(jù)上述實驗可知NaHCO3溶液顯堿性,結(jié)合材料一、二從微觀角度說明原因:。
②根據(jù)本實驗,可知從0~30s,單位體積溶液中H+數(shù)目不斷(填“增大”或“減小”)。發(fā)布:2024/12/25 17:0:2組卷:94引用:2難度:0.4 -
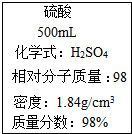 3.圖是一瓶濃硫酸標(biāo)簽上的部分內(nèi)容,某探究小組的同學(xué)對這瓶硫酸進(jìn)行了如下探究,請你參與.
3.圖是一瓶濃硫酸標(biāo)簽上的部分內(nèi)容,某探究小組的同學(xué)對這瓶硫酸進(jìn)行了如下探究,請你參與.
[查閱資料]濃硫酸有強(qiáng)腐蝕性,溶于水會放熱;硫酸鋇不溶于水也不溶于酸.
[探究一]濃硫酸稀釋時會放熱.
(1)稀釋濃硫酸時,所需儀器主要有,應(yīng)如何稀釋濃硫酸?.測量稀釋前后溶液的溫度,有明顯升高的現(xiàn)象.結(jié)論:濃硫酸溶于水放熱.
[探究二]稀硫酸與氫氧化鈉溶液能發(fā)生反應(yīng).圖10
(2)稀硫酸與氫氧化鈉溶液反應(yīng)的化學(xué)方程式為實驗步驟 實驗現(xiàn)象 實驗結(jié)論 先用pH試紙測定稀硫酸的pH,再逐滴加入氫氧化鈉溶液并不斷振蕩,同時測混合液的pH pH逐漸變大,
最后pH≥7稀硫酸與氫氧化鈉
溶液能發(fā)生反應(yīng).
(3)實驗中僅從溶液pH變大,而不強(qiáng)調(diào)pH≥7,不能得出稀硫酸與氫氧化鈉溶液一定發(fā)生反應(yīng)的結(jié)論,理由是.
[探究三]由于該試劑瓶瓶口密封簽已破損,同學(xué)們懷疑該濃硫酸的質(zhì)量分?jǐn)?shù)與標(biāo)簽不相符.
[提出問題]該濃硫酸的質(zhì)量分?jǐn)?shù)是否發(fā)生變化?
[實驗探究](4)取該濃硫酸和足量BaCl2溶液反應(yīng),過濾、洗滌、干燥沉淀.實驗中如何確定硫酸已完全反應(yīng).
(5)為達(dá)到實驗?zāi)康模瑢嶒炛斜仨氁獪y知的數(shù)據(jù)是.
[探究結(jié)論](6)由實驗測得的數(shù)據(jù)計算出的硫酸的質(zhì)量分?jǐn)?shù)與標(biāo)簽不符.該硫酸的質(zhì)量分?jǐn)?shù)應(yīng)98%(填“大于”或“小于”).發(fā)布:2025/1/6 8:0:1組卷:38引用:1難度:0.5
相關(guān)試卷


